დოკუმენტის სტრუქტურა
განმარტებების დათვალიერება
დაკავშირებული დოკუმენტები
დოკუმენტის მონიშვნები
კონსოლიდირებული პუბლიკაციები
| ტექნიკური რეგლამენტის - ფრინველის გრიპის დიაგნოსტიკის სახელმძღვანელოს დამტკიცების შესახებ | |
|---|---|
| დოკუმენტის ნომერი | 637 |
| დოკუმენტის მიმღები | საქართველოს მთავრობა |
| მიღების თარიღი | 30/12/2016 |
| დოკუმენტის ტიპი | საქართველოს მთავრობის დადგენილება |
| გამოქვეყნების წყარო, თარიღი | ვებგვერდი, 30/12/2016 |
| ძალაში შესვლის თარიღი | 01/05/2017 |
| სარეგისტრაციო კოდი | 240110000.10.003.019704 |
| კონსოლიდირებული პუბლიკაციები | |
დოკუმენტის კონსოლიდირებული ვარიანტის ნახვა ფასიანია, აუცილებელია სისტემაში შესვლა და საჭიროების შემთხვევაში დათვალიერების უფლების ყიდვა, გთხოვთ გაიაროთ რეგისტრაცია ან თუ უკვე რეგისტრირებული ხართ, გთხოვთ, შეხვიდეთ სისტემაში
პირველადი სახე (30/12/2016 - 01/06/2018)
|
ტექნიკური რეგლამენტის - ფრინველის გრიპის დიაგნოსტიკის სახელმძღვანელოს დამტკიცების შესახებ
|
| მუხლი 1 |
პროდუქტის უსაფრთხოებისა და თავისუფალი მიმოქცევის კოდექსის 56-ე მუხლის პირველი ნაწილის, 58-ე მუხლის მე-2 ნაწილისა და სურსათის/ცხოველის საკვების უვნებლობის, ვეტერინარიისა და მცენარეთა დაცვის კოდექსის 75-ე მუხლის მე-2 ნაწილის თანახმად, დამტკიცდეს თანდართული ტექნიკური რეგლამენტი - ფრინველის გრიპის დიაგნოსტიკის სახელმძღვანელო. |
| მუხლი 2 |
დადგენილება ამოქმედდეს 2017 წლის 1 მაისიდან. |
|
ტექნიკური რეგლამენტი - ფრინველის გრიპის დიაგნოსტიკის სახელმძღვანელო
|
თავი I
შესავალი, მიზნები და ტერმინთა განმარტებები |
მუხლი 1. ზოგადი დებულებები
1. ფრინველის გრიპის დიაგნოსტიკის ერთგვაროვანი პროცედურების უზრუნველყოფის მიზნით, „ტექნიკური რეგლამენტი - ფრინველის გრიპის დიაგნოსტიკის სახელმძღვანელო“ (შემდეგში - დიაგნოსტიკის სახელმძღვანელო) ადგენს: ა) რეკომენდაციებსა და მინიმალურ მოთხოვნებს დიაგნოსტიკის პროცედურებთან, ნიმუშების აღების მეთოდებთან დაკავშირებით და კრიტერიუმებს ლაბორატორიული გამოკვლევებით მიღებული შედეგების შეფასებისათვის; ბ) ლაბორატორიულ გამოკვლევებს, რომლებიც გამოყენებული უნდა იქნეს ფრინველის გრიპის დიაგნოსტიკისათვის და მეთოდებს ვირუსის იზოლატის გენოტიპირებისათვის; გ) ბიოუსაფრთხოების მინიმალურ მოთხოვნებს და ხარისხის სტანდარტებს, რომლებიც დაცული უნდა იქნეს ნიმუშის ტრანსპორტირებისას და ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიის მიერ. 2. დიაგნოსტიკის სახელმძღვანელო განკუთვნილია ფრინველის გრიპის კონტროლზე პასუხისმგებელი უწყებისათვის - საქართველოს სოფლის მეურნეობის სამინისტროს სახელმწიფო კონტროლს დაქვემდებარებული საჯარო სამართლის იურიდიული პირის - სურსათის ეროვნული სააგენტოს (შემდგომში - სააგენტო) და ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიებისათვის. მუხლი 2. ტერმინთა განმარტებები დიაგნოსტიკის სახელმძღვანელოს მიზნებისათვის „ცხოველთა გადამდები დაავადებების საწინააღმდეგო პროფილაქტიკურ-საკარანტინო ღონისძიებათა განხორციელების წესების დამტკიცების შესახებ“ საქართველოს მთავრობის 2015 წლის 14 ივლისის №348 დადგენილებით დამტკიცებული ,,ფრინველის გრიპთან ბრძოლის პროფილაქტიკურ-საკარანტინო ღონისძიებათა წესში“ (შემდგომში - წესი) გამოყენებული ტერმინების გარდა, გამოიყენება ტერმინები, რომელთაც აქვს შემდეგი მნიშვნელობა: ა) დიაგნოსტიკისათვის განკუთვნილი ნიმუში - ნებისმიერი ცხოველური მასალა, ცხოველის მთლიანი ტან-ხორცის ჩათვლით, რომელიც ტრანსპორტირებულია დიაგნოსტიკის ან საკვლევი მიზნებისათვის, გარდა ცოცხალი დაინფიცირებული ცხოველებისა; ბ) HPAI - ფრინველის მაღალპათოგენური გრიპი; გ) LPAI - ფრინველის დაბალპათოგენური გრიპი; დ) HA - ჰემაგლუტინინი; ე) NA - ნეირამიდაზა; ვ) HI - ჰემაგლუტინაციის ინჰიბირება; ზ) DIVA - ვაქცინირებული და დაინფიცირებული ცხოველების დიფერენცირება; თ) RDE - ფერმენტის გამანადგურებელი რეცეპტორით; ი) ELISA - ენზიმ შემაკავშირებელი იმუნო-ფერმენტული ანალიზი; კ) PCR- პოლიმერაზული ჯაჭვური რეაქცია; ლ) SPF - სპეციფიური პათოგენებისგან თავისუფალი; მ) SAN - ანტისხეულებზე უარყოფითი შრატი; მუხლი 3. ფრინველის გრიპის დადასტურება 1. ფრინველში ან ჩაკეტილ სივრცეში მყოფ სხვა ფრინველში ფრინველის გრიპის დადასტურება უნდა განხორციელდეს ამ დიაგნოსტიკის სახელმძღვანელოში გათვალისწინებული პროცედურების, ნიმუშის აღების მეთოდებისა და ლაბორატორიული გამოკვლევების შედეგების შეფასების კრიტერიუმების შესაბამისად და უნდა ეფუძნებოდეს ერთ ან მეტ კრიტერიუმს: ა) ვირუსის, ანტიგენის ან სპეციფიური გენეტიკური მასალის გამოვლენა ფრინველის ან სხვა ჩიტის ქსოვილში, ორგანოებში, სისხლში ან ექსკრემენტში; ბ) ფრინველში დაავადების კლინიკური ნიშნების და პათანატომიური ცვლილებების გამოვლენა; გ) ფრინველის სისხლში სპეციფიკური ანტისხეულების აღმოჩენა. 2. ძუძუმწოვრების A ტიპის, მაღალი პათოგენურობის ან H5 ან H7 დაბალი პათოგენურობის მქონე ფრინველის გრიპის გამომწვევი ვირუსით დაინფიცირების დადასტურება უნდა ეფუძნებოდეს ერთ ან მეტ კრიტერიუმს: ა) ვირუსის, ანტიგენის ან სპეციფიური გენეტიკური მასალის გამოყოფა ძუძუმწოვრების ქსოვილიდან, ორგანოებიდან, სისხლიდან ან ექსკრემენტებიდან აღებულ ნიმუშში; ბ) ძუძუმწოვრების სისხლში სპეციფიური ანტისხეულების აღმოჩენა. 3. ლაბორატორიული გამოკვლევების პროცედურები, ნიმუშის აღების მეთოდები და შედეგების შეფასების კრიტერიუმები უნდა აკმაყოფილდებდეს ერთ-ერთი ქვემოთ წარმოდგენილ მოთხოვნას: ა) გათვალისწინებული უნდა იქნეს ამ დიაგნოსტიკის სახელმძღვანელოთი; ბ) ლაბორატორიული ტესტის მგრძნობელობისა და სპეციფიკურობის გამოვლენა უნდა მოხდა ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე რეფერენს ლაბორატორიის მიერ ორგანიზებული შედარებითი ტესტირებით. თავი I I დიფერენციულ დიაგნოზზე აქცენტით ფრინველის გრიპის დახასიათება მუხლი 4. ეტიოლოგია და ვირულენტობა 1. ფრინველის გრიპი წარმოადგენს მაღალკონტაგიოზურ ვირუსულ ინფექციას. მისი გამომწვევია Orthomyxoviridae ოჯახის influenzavirus A. ტიპი, რომლზეც მგრძნობიარეა ფრინველის მრავალი სახეობა; წყლის ფრინველი წარმოადგენს აღნიშნული სახის ვირუსის ძირითად რეზერვუარს, თუმცა ეკონომიური მნიშვნელობის მქონე ფრინველში (ქათმი, ინდაური) გამოვლენილი შტამების უმრავლესობა აღმოჩნდა დაბალპათოგენური. 2. A ტიპის გრიპის ვირუსს გააჩნია ანტიგენურად დაკავშირებული ნუკლეოპროტეინები და მატრიცას პროტეინები, თუმცა ზედაპირული გლიკოპროტეინების HA-თან და NA-თან ანტიგენური კავშირის გამო ზემოაღნიშნული კლასიფიცირებულია, როგორც ქვეტიპი. მოცემული დროისათვის, აღიარებულია 16 HA (H1–H16) და 9 NA (N1–N9) ქვეტიპები. A ტიპის გრიპის გამომწვევ ყველა ვირუსს გააჩნია ერთი HA და ერთი NA ანტიგენი, რომელიც ნათლად ჩანს ნებისმიერ კომბინაციაში. 3. ამთვისებელ ფრინველში დაავადების გამოწვევის უნარის მიხედვით A ტიპის გრიპის ვირუსი იყოფა ორ ჯგუფად: ა) HPAI-ის ვირუსი, რომელიც იწვევს დაინფიცირებულ ფრინველში უკიდურესად მძიმე დაავადებას და ხასიათდება გენერალიზებული ფორმით, რასაც ფრინველის გუნდში შესაძლოა მოჰყვეს მაღალი სიკვდილიანობა (100%–მდე); ბ) LPAI-ის ვირუსი, რომელმაც შესაძლოა პირველ რიგში გამოიწვიოს სუსტი რესპირატორული დაავადება ფრინველში, გარდა იმ შემთხვევისა, თუ არ არსებობს სხვა თანა–ინფექცია ან სხვა ფაქტორებით გამოწვეული გართულება. 4. გარეული ფრინველი, განსაკუთრებით კი წყლის გადამფრენი ფრინველი, მნიშვნელოვან როლს ასრულებს, როგორც A ტიპის გრიპის გამომწვევი ვირუსის რეზერვუარი, რაც თავის მხრივ ჩანს გარეული ფრინველიდან HA და NA ქვეტიპების თითქმის ყველა შესაძლო კომბინაციის გამოყოფით. ზოგადად, დაინფიცირებული ფრინველისგან HPAI ვირუსის გავრცელების შემთხვევების გარდა, გარეულ ფრინველში აღმოჩენილია მხოლოდ LPAI ვირუსი. 5. საფრინველეში ფრინველის გრიპის ვირუსის პირველადი შეტანა სავარაუდოდ დაკავშირებულია გარეულ ფრინველთან პირდაპირი ან არაპირდაპირი კონტაქტით. 6. გარეული ფრინველის რეზერვუარიდან შემოჭრილი LPAI ვირუსით გამოწვეული დაავადება შესაძლოა ფრინველში მიმდინარეობდეს უსიმპტომოდ, ვინაიდან უმეტეს შემთხვევაში ამ ვირუსით გამოწვეული კლინიკური ნიშნები სუსტია ან საერთოდ არ არის გამოხატული. 7. H5 და H7 წარმომავლობის LPAI ვირუსმა ფრინველში შეჭრის შემდგომ შესაძლოა განიცადოს HPAI შტამად მუტაცია. დღეისათვის, HPAI გამომწვევად განისაზღვრება მხოლოდ H5 და H7 ქვეტიპები. 8. LPAI ვირუსიდან HPAI ვირუსად მუტაცია ხორციელდება რამოდენიმე მექანიზმით, თუმცა მუტაციის გამომწვევი ფაქტორები კვლავაც უცნობია. რიგ შემთხვევებში, მუტაცია ხორციელდება სწრაფად, გარეული ფრინველიდან ვირუსის შეჭრისთანავე, ხოლო სხვა შემთხვევებში LPAI ვირუსი ფრინველში ცირკულირებს მუტაციამდე თვეების განმავლობაში. აქედან გამომდინარე, შეუძლებელია მუტაციის შესაძლებლობის და განხორციელების დროის წინასწარ განსაზღვრა. სავარაუდოდ, რაც უფრო მაღალია ფრინველში LPAI ვირუსის ცირკულაცია, მით უფრო მაღალია HPAI ვირუსად მუტაციის შესაძლებლობა. 9. საინკუბაციო პერიოდი სავარაუდოდ დამოკიდებულია ვირუსის შტამსა და მასპინძელზე, ზოგადად აღნიშნული პერიოდი გრძელდება ხუთიდან ექვს დღემდე, თუმცა ცალკეულ ფრინველთან მიმართებაში აღნიშნული ვადა მერყეობს რამოდენიმე საათიდან შვიდ დღემდე. მუხლი 5. HPAI ვირუსით დაინფიცირებული ფრინველის კლინიკური ნიშნები 1. HPAI ვირუსით დაინფიცირებული ფრინველის კლინიკური ნიშნები საკმაოდ ცვალებადია და მათზე ზეგავლენას ახდენს ისეთი ფაქტორები, როგორიცაა დამაინფიცირებელი ვირუსის ვირულენტობა, დაინფიცირებულის სახეობა, ასაკი, სქესი, თანმდევი დაავადებები და გარემო. 2. ადრეული კლინიკური ნიშნები შესაძლოა მოიცავდეს უმადობას, წყლის მიღების შემცირებას და სიკვდილიანობის შედარებით დაბალ მაჩვენებელს. თუმცა, შესაძლოა დაავადება მოულოდნელად გამოვლინდეს ფრინველთა გუნდში და მრავალი ფრინველი მოკვდეს კლინიკური ნიშნების გამოვლენის გარეშე ან დეპრესიის, უმადობის, გაფხორილი ბუმბულის ან ცხელების მინიმალური ნიშნების თანხლებით. ზოგადად, რაც უფრო დიდხანს ძლებს ფრინველი, მით მეტია კლინიკური ნიშნების გამოვლენა. კლინიკური ნიშნების განვითარების პერიოდი დამოკიდებულია ფრინველის შენახვის სისტემასთან ერთად ვირუსზე, მასპინძელზე და საწყის დამაინფიცირებელ დოზაზე. ჩაკეტილ სივრცეში ან გარეთ მყოფ ფრინველში ვირუსი შედარებით ნელა ვრცელდება ვიდრე საფრინველეში. 3. HPAI ვირუსით დაინფიცირებულმა ქათამმა თავდაპირველად შესაძლოა დადოს რბილ-ნაჭუჭიანი კვერცხი, მაგრამ მალევე შეწყვიტოს კვერცხის დება. დაინფიცირებული ფრინველი ხშირად ზის ან დგას ნახევრად კომატოზურ მდგომარეობაში და თავით ეხება მიწას. ბიბილო და საყურე არის ციანოზური, შეშუპებული და შესაძლოა აღენიშნებოდეს პეტექიური ან ეკხიმოზური ჰემორაგია სხეულის დაბოლოებებში. ხშირად მასიური ფაღარათის გამო ფრინველს აქვს წყურვილის მოჭარბებული შეგრძნება. შესაძლოა გართულდეს სუნთქვა და ადგილი ჰქონდეს მოჭარბებულ ცრემლდენას. სისხლჩაქცევები შესამჩნევია კანის ისეთ ნაწილებზე, რომლებიც არ არის დაფარული ბუმბულით. ფრინველთა გუნდის სიკვდილიანობის კოეფიციენტი მერყეობს 50%-დან 100%-მდე. 4. სხვა დანარჩენ ფრინველთან შედარებით ბროილერში HPAI-ის ნიშნები ნაკლებად არის გამოვლენილი და როგორც წესი მოიცავს მწვავე დეპრესიას, უმადობას და სიკვდილიანობის მაჩვენებლის ზრდა შესაძლოა წარმოადგენდეს პირველ გამოვლენილ პათოლოგიას. აგრეთვე შესაძლოა ადგილი ჰქონდეს სახის, კისრის შესიებას და ისეთ ნევროლოგიურ ნიშნებს, როგორიცაა გამრუდებული კისერი და ატაქსია. 5. HPAI ინდაურში და სხვა ფრინველში გამოვლინდება ერთნაირი კლინიკური ნიშნებით, მაგრამ ზოგიერთი HPAI-ის გამომწვევი ვირუსი სხვებთან შედარებით უფრო ვირულენტურია ინდაურში. 6. HPAI-ის გამომწვევი ვირუსით დაინფიცირებულ ბატში დეპრესიის, უმადობის და დიარეის კლინიკური ნიშნები მსგავსია კვერცხმდებელ ფრინველში დაავადების კლინიკური ნიშნებისა, თუმცა ხშირად ვლინდება შეშუპებული სინუსებით. ახალგაზრდა ფრინველში შესაძლებელია გამოვლენილი იქნეს ნევროლოგიური ნიშნებიც. 7. იხვის HPAI-ის გამომწვევი ვირუსით დაინფიცირების შემთხვევაში შესაძლოა არ გამოვლინდეს კლინიკური ნიშნები, თუმცა ზოგიერთი შტამით დაინფიცირებისას ვლინდება ისეთი კლინიკური ნიშნები, რომლებიც ბატებში იწვევს მაღალ სიკვდილიანობას. 8. კლინიკური ნიშნები აგრეთვე შესაძლოა არ გამოვლინდეს LPAI-ის და HPAI-ის გამომწვევი ვირუსით სირაქლემის დაინფიცირების დროს. იტალიაში 1999 და 2000 წლებში HPAI-ის აფეთქებისას ციცარი და იაპონური მწყერიც ამთვისებელნი აღმოჩნდნენ და გამოვლენილი დაავადების ნიშნები და სიკვდილიანობა მსგავსი იყო ქათამსა და ინდაურში გამოვლენილ ნიშნებისა და სიკვდილიანობისა. თუმცა, რიგი ექსპერიმენტული კვლევების შედეგად გამოვლენილი იქნა ციცარის რეზისტენტობა ზოგიერთი HPAI-ის გამომწვევი ვირუსის შტამების მიმართ. ყველა ფრინველთან დაკავშირებით, ვაქცინაციის ან ბუნებრივი დაინფიცირების შედეგად ანტისხეულების არსებობა ზოგიერთ H ქვეტიპებთან მიმართებაში შესაძლოა ნიშნავდეს იმას, რომ HPAI-ის გამომწვევი ვირუსით დაინფიცირებას არ მოჰყვეს აშკარა კლინიკური ნიშნების გამოვლენა. მუხლი 6. HPAI-ის გამომწვევი ვირუსით დაინფიცირებული ფრინველის სიკვდილის შემდგომი პათოლოგ-ანატომიური ცვლილებები 1. ფრინველის მაღალპათოგენური გრიპის მწვავე მიმდინარეობის შედეგად მკვდარ ფრინველში შესაძლოა გამოვლენილი იქნეს მინიმალური დაზიანებები, როგორიცაა ნაწლავებისა და კუნთების დეჰიდრატაცია და ჰიპერემია. ხანგრძლივი კლინიკური ფორმით მიმდინარე ფრინველის მაღალპათოგენური გრიპით მკვდარ ფრინველში პეტექიური და ეკხიმოზური ჰემორაგია ვრცელდება მთელს სხეულზე, კერძოდ, კი ხორხზე, ტრაქეაზე, წინაკუჭისა და ეპიკარდიალურ ცხიმოვან უჯრედებზე, მკერდის ძვლის მიმდებარე სეროზულ ზედაპირზე. თავისა და ტერფის მიდამოებში შეინიშნება მძაფრი შეშუპება. ლეში შესაძლოა დეჰიდრატირებული იყოს. ყვითელი ან ნეკროზული კერები შესაძლოა აღმოჩენილი იქნეს ელენთაში, ღვიძლში, თირკმელში და ფილტვში. ალვეოლაში შესაძლოა იყოს ექსუდატი, ელენთა კი - გადიდებული და ჰემორაგიული. 2. ჰისტოლოგიურად ფრინველის გრიპის ტიპის გრიპი ხასიათდება სისხლძარღვების პათოლოგიებით, რასაც თან სდევს შეშუპება, ჰემორაგია და პერივასკულარული ლეიკოციტოზი, განსაკუთრებით კი მიოკარდში, ელენთაში, ფილტვში, ტვინში, პანკრეასში და ყურებთან. ნეკროზული კერები წარმოდგენილია ფილტვში, ღვიძლში და თირკმელში. გლიოზი - ვასკულარული პროლიფერაცია და ნეირონული დეგენერაცია - შესაძლოა წარმოდგენილი იქნეს ტვინში. მუხლი 7. HPAI -ის დიფერენციული დიაგნოზი HPAI-ის დიფერენციული დიაგნოზისას გათვალისწინებული უნდა იქნეს შემდეგი დაავადებები: ა) მოულოდნელი მაღალი სიკვდილიანობის გამომწვევი დაავადებები: ა.ა) ნიუკასლის დაავადება; ა.ბ) ინფექციური ლარინგოტრაქეიტი; ა.გ) იხვის ჭირი; ა.დ) მწვავე მოწამვლა; ბ) სხვა დაავადებები, რომლებიც იწვევენ ბიბილოს და საყურეს შეშუპებას: ბ.ა) ფრინველის მწვავე ქოლერა და სხვა სეპტიცემიური დაავადებები; ბ.ბ) ბიბილოს და საყურეს შემაერთებელი ქსოვილის ბაქტერიული ცელულიტი. მუხლი 8. LPAI-ის გამომწვევი ვირუსით დაინფიცირებული ფრინველის კლინიკური ნიშნები 1. LPAI-ის სიმწვავეზე ზეგავლენას ახდენს: ა) ვირუსის შტამი; ბ) მასპინძლის სახეობა და ასაკი; გ) მასპინძლის იმუნური ფონი ვირუსთან დაკავშირებით, კერძოდ, სხვა ინფექციური აგენტების არსებობა, როგორიცაა: გ.ა) Pasteurella spp; გ.ბ) ნიუკასლის დაავადების გამომწვევი ვირუსი (ვაქცინის შტამის ჩათვლით); გ.გ) ფრინველების პნევმოვირუსი, ინფექციური ბრონქიტის ვირუსი; გ.დ) E. coli; გ.ე) Mycoplasma spp; გ.ვ) იმუნოდეფიციტი; გ.ზ) გარემო ფაქტორები ( მოჭარბებული ამიაკი, მტვერი, ცხელი ან ცივი ტემპერატურა). 2. ერთის მხრივ, დაავადების კლინიკური ნიშნები შესაძლოა გამოხატული იყოს სიმპტომების გარეშე ან უმნიშვნელო სიმპტომებით, რომელიც თავის მხრივ იწვევს მხოლოდ სუსტ რესპირატორულ ნიშნებს ან კვერცხისმდებელ ფრინველში კვერცხის დებასთან დაკავშირებულ პრობლემებს, მეორეს მხრივ, LPAI-ის გამომწვევი ვირუსით გამოწვეული ინფექციები შესაძლოა უკავშირდებოდეს დაავადების მწვავე კლინიკურ ნიშნებს, განსაკუთრებით კი ინდაურში. აღნიშნული კლინიკური ნიშნები ძირითადად ვლინდება ხიხინით, ხველებით, ინფრაორბიტალური სინუსების შეშუპებით და ციებ–ცხელების მდგომარეობით, რომელიც იწვევს მადის დაკარგვას და სიკვდილიანობის მაღალ მაჩვენებელს. 3. LPAI შესაძლოა აგვერიოს ან გართულდეს რესპირატორული ან ენტერო ნიშნების მქონე სხვა დაავადებებით. ფრინველში ნებისმიერი დაავადების აფეთქებისას, რომელიც გრძელდება ხანგრძლივად, მიუხედავად სხვა დაავადებების პრევენციული და თერაპიული ღონისძიებებისა, უნდა ვივარაუდოთ რომ ადგილი აქვს ფრინველის გრიპს. მუხლი 9. ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკური ნიშნები 1. კლინიკური ნიშნები შესაძლოა საკმაოდ მრავალფეროვანი იყოს, როგორც ფრინველში, ისე ჩაკეტილ სივრცეში მყოფ სხვა ფრინველში. ფრინველის დაბალპათოგენური გრიპი შესაძლოა მიმდინარეობდეს, როგორც უსიმპტომოდ ასევე მძიმედ, რამაც შეიძლება გამოიწვიოს მაღალი სიკვდილიანობა. 2. ჩაკეტილ სივრცეში მყოფ ფრინველში ინფექცია ძირითადად შედარებით ნელა ვრცელდება განსხვავებული სახეობების, სხვადასხვა ამთვისებლობის, ვირუსის გამოყოფის რაოდენობისა და ხშირად ნელი ტრანსმისიის გამო, რომელიც გამოწვეულია კონტაქტის სიმცირითა და ფრინველის განთავსების შედარებით დაბალი სიმჭიდროვით. თავი III საფრინველეში ფრინველის გრიპზე ეჭვის შემთხვევაში გასათვალისწინებელი მოთხოვნები მუხლი 10. დიაგნოსტიკის ეტაპების სქემატური მიმოხილვა ფრინველის გრიპის დადასტურებისთვის 1. HPAI და LPAI კლინიკური ნიშნების მრავალფეროვნების გამო დაავადების აფეთქებაზე ეჭვის მიტანისას შეუძლებელია კონკრეტული მითითებების გაცემა. მე–2 თავში აღწერილი უეცარი სიკვდილიანობის მაღალი კოეფიციენტი ფრინველში, კლინიკური ნიშნებით ან მათ გარეშე, შესწავლილი უნდა იქნეს ლაბორატორიული გამოკვლევებით, თუმცა სიკვდილიანობის მაღალი კოეფიციენტის არარსებობის შემთხვევაში, საკმაოდ რთულია ფრინველის გრიპზე ეჭვისმიტანა ან გამორიცხვა. 2. H5 და H7 ქვეტიპებით გამოწვეული HPAI ან LPAI სწრაფი დიაგნოსტიკა მნიშვნელოვანია დაავადების ადრეული კონტროლისა და აღმოფხვრისათვის. ფრინველში სიკვდილიანობის ზრდის შემთხვევები, კვერცხის დებასთან დაკავშირებული და რესპირატორული პრობლემები ყოველთვის უნდა იქნეს გათვალისწინებული დიფერენციული დიაგნოზის დროს, რისთვისაც შესაბამისი ნიმუშები გადაგზავნილი უნდა იქნეს ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიაში გამოკვლევისათვის. 3. დიაგნოსტიკის ეტაპების სქემატური მიმოხილვა ფრინველი გრიპის დადასტურებისთვის მოცემულია ამ დიაგნოსტიკური სახელმძღვანელოს დანართში №1 „დიაგნოსტიკის ეტაპების სქემატური მიმოხილვა ფრინველის გრიპის დადასტურებისათვის“. თავი IV ნიმუშების შეგროვებისა და ტრანსპორტირების ზოგადი მოთხოვნები მუხლი 11. წესი და დიაგნოსტიკის სახელმძღვანელო როდესაც წესში მითითებულია დიაგნოსტიკის სახელმძღავნელო, ჩატარებული უნდა იქნეს ამ თავში წარმოდგენილი გამოკვლევები, ნიმუშების აღებისა და მონიტორინგის პროცედურები. მუხლი 12. ფრინველის გრიპის აფეთქებაზე ეჭვის შემთხვევაში გასატარებელი ზომები თუ ვეტერინარს აქვს ეჭვი ფრინველის გრიპის აფეთქებაზე, ან თუ დაავადებასთან დაკავშირებით ჩატარებული რომელიმე ლაბორატორიული გამოკვლევა არ აჩვენებს უარყოფით შედეგს, სააგენტომ უნდა უზრუნველყოს ამ თავით გათვალისწინებული გამოკვლევების ჩატარება დაავადების გამორიცხვამდე წესის მე–7 მუხლის შესაბამისად. მუხლი 13. ვირუსოლოგიური გამოკვლევის ინტერპრეტაცია სააგენტომ უნდა განიხილოს ფრინველის გრიპის გამომწვევი ვირუსის არსებობის გამორიცხვა მას შემდგომ, რაც ვირუსის ან მისი გენომის აღმოჩენის მიზნით, ამ თავის შესაბამისად დადგენილი შესაბამისი რაოდენობის დაავადებული ან მკვდარი ფრინველის და ტრაქეალური/ოროფარენგეალური ან კლოაკალური ნაცხის და ამ დიაგნოსტიკური სახელმძღვანელოს პირველი თავის მე-3 მუხლის მე-3 პუნქტის ,,ბ“ ქვეპუნქტის თანახმად, ავტორიზებული და მე–5 ან მე–6 თავებში განსაზღვრული აღმოჩენის მეთოდების გამოყენებით ჩატარებული გამოკვლევები უარყოფითი შედეგით დასრულდა. მუხლი 14. ვირუსოლოგიური ან სეროლოგიური ლაბორატორიული გამოკვლევებისათვის საჭირო ნიმუშების სტანდარტული რაოდენობა 1. ფრინველის გრიპის გამომწვევი ვირუსით საფრინველეს დაინფიცირებაზე ეჭვის შემთხვევაში, გამოკვლევისათვის გათვალისწინებული უნდა იქნეს ვირუსოლოგიური ან სეროლოგიური გამოკვლევისათვის ამ მუხლის მე-2-მე-8 პუნქტებში მითითებული სტანდარტული ნიმუშების რაოდენობა. 2. ვირუსოლოგიური გამოკვლევისათვის ნიმუშების სტანდარტული რაოდენობა მოიცავს არანაკლებ ხუთ დაავადებულ/მკვდარ ფრინველს, ასეთის არსებობის შემთხვევაში და/ან სულ მცირე 20 ტრაქეალურ/ოროფარინგეალურ და 20 კლოაკალურ ნაცხს. 3. გამოკვლევისათვის აღებული უნდა იქნეს იმ ფრინველების ლეში, რომელებიც მოკვდნენ ბოლო დროს ან მძიმედ დაავადებულნი ან მომაკვდავნი არიან და მოკლული იქნენ ჰუმანური მეთოდით. 4. ნაცხი აღებული უნდა იქნეს ფრინველის იმ რაოდენობიდან, რომელიც მითითებულია ამ მუხლის მე-2 პუნქტში ან ყველა ფრინველიდან დაავადებაზე საეჭვო საფრინველეში თუ მასში განთავსებულია ფრინველის მცირე რაოდენობა. ნიმუშების აღება ხდება კლინიკური ნიშნების მქონე ფრინველიდან. 5. კლოაკალური ნაცხი დაფარული უნდა იქნეს ფეკალიებით (ოპტიმალური რაოდენობა 1 გრ). თუ რაიმე გარკვეული მიზეზის გამო ცოცხალი ფრინველიდან შეუძლებელია კლოაკალური ნაცხის აღება, ალტერნატიულ საშუალებას წარმოადგენს ახლად გამოყოფილი ექსკრემენტებიდან აღებული ნიმუში. ხშირად, ტრაქეალურ/ოროფარინგეალური ნიმუშის აღება გაცილებით მარტივი და პრაქტიკულია პირის ღრუდან. 6. როგორც კი ცნობილი გახდება ფრინველის გრიპის გამომწვევი ვირუსის გავრცელების მახასიათებლები, სააგენტოს მიერ შერჩეული უნდა იქნეს ტრაქეალური/ოროფარინგეალური ან კლოაკალური ნაცხი იმის მიხედვით, თუ რომელი წარმოადგენს ხელსაყრელ არეს ვირუსის გამრავლებისათვის – რესპირატორული თუ კუჭნაწლავის ტრაქტი. ამასთანავე, გათვალისწინებული უნდა იქნეს ფრინველის შესაბამისი სახეობები. 7. სეროლოგიური გამოკვლევისათვის ნიმუშების სტანდარტული რაოდენობაა სისხლის არანაკლებ 20 ნიმუში, რომელიც აღებულ უნდა იქნეს 20 ფრინველიდან ან იმ საფრინველეს ყველა ფრინველიდან, რომელშიც განთავსებულია ფრინველის მცირე რაოდენობა. ნიმუშების აღება ხდება კლინიკური ნიშნების მქონე ან გამოჯანმრთელებული ფრინველიდან. 8. სააგენტომ შეიძლება გადაწყვიტოს ნაცვლად სტანდარტული ნიმუშების სრული რაოდენობისა აღებული იქნეს სტანდარტული ნიმუშების შემცირებული რაოდენობა. მუხლი 15. ნიმუშების ტრანსპორტირება 1. განსაკუთრებული სიფრთხილით უნდა განხორციელდეს ნიმუშების შენახვა და ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიაში გამოკვლევისათვის ტრანსპორტირება. 2. ნაცხი გაციებული უნდა იქნეს დაუყოვნებლივ ყინულის ან გელის გაყინული პაკეტის მეშვეობით და გადაგზავნილი ფრინველის გრიპზე მომუშავე ლაბორატორიაში შეძლებისდაგვარად სწრაფად. თუ ნიმუშის ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიაში ტრანსპორტირება შეუძლებელია 24 საათის განმავლობაში, ნიმუში დაუყოვნებლივ უნდა იქნეს გაყინული, შენახული და შემდეგ ტრანსპორტირებული მშრალი ყინულის გამოყენებით. 3. გარდა გაციებისა, ნაცხი სრულად უნდა იქნეს მოთავსებული ანტიბიოტიკურ არეში ან ვირუსის სპეციალურ სატრანსპორტო ნიადაგში 4oC-ზე. ასეთი საშუალების არ არსებობისას ნაცხი დაუყოვნებლივ უნდა იქნეს დაბრუნებული ბუდეში და მიეწოდოს ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიას მშრალ მდგომარეობაში. 4. ნიმუშის შენახვასა და ტრანსპორტირებაზე შესაძლოა ზეგავლენა მოახდინოს მრავალმა ფაქტორმა, რისთვისაც ტრანსპორტირებისათვის შერჩეული მეთოდი უნდა იქნეს მიზნის ადეკვატური. მუხლი 16. ანტიბიოტიკური არე 1. ამ დიაგნოსტიკური სახელმძღვანელოს მე-15 მუხლის მე-3 პუნქტით გათვალისწინებული ანტიბიოტიკური არე უნდა ეფუძნებოდეს ფოსფატით ბუფერირებულ ფიზიოლოგიურ ხსნარს, რომლის pH 7,0–დან 7,4–მდეა (pH-ის შემოწმება უნდა მოხდეს ანტიბიოტიკების დამატების შემდგომ). 2. პროტეინზე დაფუძნებული საკვები არე, როგორიცაა გულის და ტვინის ექსტრაქტის ბულიონი ან ტრის–ბუფერირებული ბულიონი, ხელს უწყობს ვირუსის სტაბილურობას, განსაკუთრებით კი ტრანსპორტირებისას. გამოყენებული ანტიბიოტიკები და მათი კონცენტრაციები შესაძლოა მერყეობდეს ადგილობივ პირობებიდან (მდგომარეობიდან) და შესაძლებლობებიდან გამომდინარე. 3. ფეკალური ნიმუშებისათვის შესაძლოა საჭირო იყოს ანტიბიოტიკების ძალიან მაღალი შემცველობა, კერძოდ: 10 000 IU/მლ პენიცილინი, 10 მგ/მლ სტრეპტომიცინი, 0,25 მგ/მლ გენტამიცინი, და 5 000 IU/მლ ნისტატინი. ქსოვილებისა და ტრაქეალური ნაცხისათვის აღნიშნული შემცველობა შესაძლოა შემცირებული იქნეს ხუთჯერ. 4. ქლამიდოფილიის კონტროლის საჭიროების შემთხვევაში, გამოყენებული უნდა იქნეს 0,05–დან 0,1 მგ/მლ ოქსიტეტრაციკლინი. მუხლი 17. ტვინის და გულის ექტრაქტის ბულიონი 1. სტერილიზაციამდე (121oC/15 წუთით ავტოკლავირებით) ხსნარი მზადდება წყლით და უნდა შეიცავდეს 15% w/v ტვინისა და გულის მშრალ ბულიონს. 2. სტერილიზაციის შემდგომ ემატება ანტიბიოტიკები შემდეგი სქემით: 10 000 IU/მლ პენიცილინი G, 20 µg ამფოტერიცინი B და 1 000 µg/მლ გენტამიცინი. საკვები არის შენახვა შესაძლებელია 4oC ტემპერატურაზე არაუმეტეს ორი თვისა. მუხლი 18. წესის მე-7 მუხლის პირველი პუნქტით განსაზღვრულ საფრინველეში დაავადების აფეთქებაზე ეჭვის შემთხვევაში გასატარებელი ზომები სახელმწიფო ვეტერინარმა დაავადების აფეთქებაზე საეჭვო საფრინველეს ინსპექტირებისას, უნდა გაატაროს შემდეგი ზომები: ა) საფრინველეს ჯანმრთელობისა და პროდუქტიულობის შესახებ ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში. სახელმწიფო ვეტერინარის მიერ ინსპექტირების აქტში უნდა მიეთითოს სიკვდილიანობის, კვერცხის დების, საკვების და/ან წყლის მიღების ყოველდღიური მონაცემები, რომელიც მოიცავს პერიოდს ფრინველის გრიპის კლინიკური ნიშნების გამოვლენამდე ერთი კვირით ადრე პერიოდიდან სახელმწიფო ვეტერინარის მიერ საფრინველეს შემოწმების დღის ჩათვლით; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს კლინიკური ისტორიის შეფასებას და დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის შესწავლას; გ) ვიდრე სააგენტო მიიღებს შეტყობინებას იმის თაობაზე, რომ ამ მუხლის ,,ა“ და „ბ“ ქვეპუნქტების თანახმად გამოირიცხა აფეთქება კლინიკური შემოწმების საფუძველზე, თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები ლაბორატორიული გამოკვლევისათვის; დ) სტანდარტული ნიმუშების შემოწმების უარყოფითი შედეგებისა და ადგილობრივი ფაქტორებისგან დამოუკიდებლად, ფრინველის კლინიკური შემოწმება საწარმოო ერთეულის თითოეულ ჯგუფში უნდა განხორციელდეს სახელმწიფო მონიტორინგის გაუქმებამდე. მუხლი 19. წესის მე-10 მუხლის მე-3 და მე-4 პუნქტებით განსაზღვრული ეპიდემიოლოგიური მოკვლევის შედეგებიდან გამომდინარე დამატებითი ზომები თითოეულ საწარმოო ერთეულში აღებული უნდა იქნეს სტანდარტული ნიმუშები მოკლული ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი მოკლული ფრინველიდან. მუხლი 20. წესის მე-11 მუხლის მე-7 პუნქტით დადგენილი ზომების გატარება თუ ფრინველი გამოჩეკილია იმ საფრინველეში შეგროვებული კვერცხიდან, სადაც ადგილი აქვს HPAI-ის აფეთქებას, ამ მუხლში მითითებული ზომები უნდა იქნეს გატარებული მაშინ, როდესაც სახელმწიფო ვეტერინარი ახორციელებს იმ საფრინველეს ინსპექტირებას, სადაც დადასტურდა HPAI და განთავსებულია ფრინველი, რომელიც გამოიჩეკა ფრინველის გრიპის საინკუბაციო პერიოდში შეგროვებული კვეერცხიდან: ა) საფრინველეს ჯანმრთელობისა და პროდუქტიულობის შესახებ ჩანაწერების შემოწმება. სახელმწიფო ვეტერინარის მიერ ინსპექტირების აქტში უნდა მიეთითოს სიკვდილიანობის, კვერცხის დების, საკვების და/ან წყლის მიღების ყოველდღიური მონაცემები, რომელიც მოიცავს პერიოდს HPAI-ის კლინიკური ნიშნების გამოვლენამდე ერთი კვირით ადრე პერიოდიდან სახელმწიფო ვეტერინარის მიერ საფრინველეს შემოწმების დღის ჩათვლით; ბ) თითოეული საწარმოო ერთეულისა და ფრინველის კლინიკური შემოწმება, განსაკუთრებით, იმ ფრინველის, რომელიც სავარაუდოდ დაავადებულია ან მათი ზრდის პროცესი არ მიმდინარეობს მოლოდინის შესაბამისად; გ) სტანდარტული ნიმუშები აღებული უნდა იქნეს ორიდან სამ კვირამდე ასაკის ფრინველიდან; დ) საფრინველეს სახელმწიფო მონიტორინგი შესაძლოა გაუქმდეს 21 დღეზე მეტი ასაკის ფრინველის კლინიკური გამოკვლევისა და სტანდარტული ნიმუშების ტესტირებაზე უარყოფითი შედეგების მიღების შემდეგ. მუხლი 21. წესის მე-13 მუხლის მე-2 პუნქტის ,,ბ“ ქვეპუნქტით დადგენილი ზოგიერთ საფრინველესთან დაკავშირებული გამონაკლისები როდესაც სახელმწიფო ვეტერინარი ახორციელებს იმ საფრინველეს შემოწმებას, რომელზეც წესის მე-11 მუხლის მე-4 პუნქტით გავრცელდა გამონაკლისები, გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველეს პროდუქტიულობისა და ჯანმრთელობის შესახებ ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, მათ შორის საავარაუდოდ დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა სავარაუდოდ დაავადებული ფრინველის, კლინიკური ისტორიის შეფასება და კლინიკური მდგომარეობის შესწავლა; გ) HPAI-ის ბოლო გამოვლენიდან 21 დღის შემდეგ, სულ მცირე 21 დღიანი ინტერვალის გათვალისწინებით ლაბორატორიული გამოკვლევების სტანდარტული ნიმუშების ნაცვლად აღებული უნდა იქნეს შემდეგი ნიმუშები: გ.ა) ადგილზე არსებული მკვდარი ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა მკვდარი ფრინველიდან ნიმუშების აღება; გ.ბ) ტრაქეალური/ოროფარინგეალური ან კლოაკალური ნაცხი აღებულ უნდა იქნეს სულ მცირე 60 ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველიდან; 60 ფრინველზე ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველზე ნაკლების შემთხვევაში ნაცხი აღებულ უნდა იქნეს არსებული რაოდენობიდან; იმ შემთხვევაში, თუ ფრინველი მცირე ზომისაა, ეგზოტიკურია და მათთან შეხება საშიშია ადამიანებისათვის, ნიმუშები შეგროვებული უნდა იქნეს ახლად გამოყოფილი ექსკრემენტებიდან. დ) რისკის შეფასების საფუძველზე სააგენტოს მიერ შესაძლოა დაშვებულ იქნეს გამონაკლისები ამ მუხლის ,,გ“ ქვეპუნქტით დადგენილ ნიმუშების რაოდენობაზე; ე) ამ მუხლის ,,გ“ ქვეპუნქტით გათვალისწინებული ნიმუშების აღება და ლაბორატორიული გამოკვლევა უნდა გაგრძელდეს ორი თანმიმდევრული უარყოფითი შედეგის მიღებამდე, რომელთა შორის ინტერვალი უნდა იყოს არანაკლებ 21 დღე. მუხლი 22. წესის მე-15 მუხლის პირველი და მე-3 პუნქტებით დადგენილ კონტაქტურ საფრინველეში გასატარებელი ზომები სახელმწიფო ვეტერინარის მიერ კონტაქტურ საფრინველეს ინსპექტირებისას გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველეში ჯანმრთელობისა და პროდუქტიულობის შესახებ ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში. სახელმწიფო ვეტერინარის მიერ ინსპექტირების აქტში უნდა მიეთითოს სიკვდილიანობის, კვერცხის დების, საკვების და/ან წყლის მიღების ყოველდღიური მონაცემები, რომელიც მოიცავს პერიოდს ფრინველის გრიპის კლინიკური ნიშნების გამოვლენამდე ერთი კვირით ადრე პერიოდიდან სახელმწიფო ვეტერინარის მიერ საფრინველეს შემოწმების დღის ჩათვლით; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს სავარაუდოდ დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა სავარაუდოდ დაავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას; გ) ფრინველში ან ჩაკეტილ სივრცეში მყოფ სხვა ფრინველში კლინიკური ნიშნების ან დღიური სიკვდილიანობის კოეფიციენტის ზრდის (ფრინველის გუნდის სიკვდილიანობის ჩვეული (ნორმალური) კოეფიციენტი >3 ჯერ) ან დღიური კვერცხდების (>5%) ან წყლის და/ან საკვების მიღების დღიური მაჩვენებლის (>5%) შემცირების შემთხვევაში, თითოეული საწარმოო ერთეულიდან დაუყოვნებლივ აღებული უნდა იქნეს სტანდარტული ნიმუშები; დ) ამ მუხლის ,,ბ“ და ,,გ“ ქვეპუნქტებით გათვალისწინებული ნიშნების არარსებობის შემთხვევაში სტანდარტული ნიმუშები აღებული უნდა იქნეს დაინფიცირებულ საფრინველესთან ბოლო სავარაუდო კონტაქტის დღიდან 21 დღეში ან როდესაც ფრინველი ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველი მოკლულია. მუხლი 23. წესის მე-18 მუხლის პირველი-მე-4 პუნქტებით დადგენილი სახელმწიფო ვეტერინარის მიერ განხორციელებული ინსპექტირება, მონაცემთა მოპოვება (აღწერა) და მონიტორინგი დამცავ ზონაში მდებარე საფრინველეში სახელმწიფო ვეტერინარის მიერ კომერციული საფრინველეს ინსპექტირებისას გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველეს პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება. დღიური სიკვდილიანობის კოეფიციენტის ზრდის (ფრინველის გუნდის სიკვდილიანობის ჩვეული (ნორმალური) კოეფიციენტი >3 ჯერ) ან კვერცხის დღიური დების (>5%) ან წყლის და/ან საკვების მიღების დღიური მაჩვენებლის (>5%) შემცირების შემთხვევაში, თითოეული საწარმოო ერთეულიდან დაუყოვნებლივ აღებული უნდა იქნეს სტანდარტული ნიმუშები; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს სავარაუდოდ დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა სავარაუდოდ დაავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას; გ) თუ ფრინველის სახეობებს ან ჩაკეტილ სივრცეში მყოფ სხვა ფრინველს არ აღენიშნებათ დაავადების გამოხატული ნიშნები, ან ვაქცინირებული ფრინველის შემთხვევაში, რისკების შეფასების საფუძველზე სააგენტომ შეიძლება გადაწყვიტოს თითოეული საწარმოო ერთეულიდან სტანდარტული ნიმუშების აღება; დ) სამიზნე საფრინველეში, კომპარტმენტში ან საწარმოო ერთეულებში კლინიკური შემოწმებითა და ლაბორატორიული ნიმუშების აღებით დამატებითი მონიტორინგის ჩატარება სააგენტომ უნდა გადაწყვიტოს რისკების შეფასების შედეგების საფუძველზე. მუხლი 24. წესის მე-19 მუხლის მე-3 პუნქტით დადგენილ დამცავ ზონაში მდებარე საფრინველეში გასატარებელი ზომები სახელმწიფო ვეტერინარის მიერ იმ საფრინველეს ინსპექტირებისას, რომელშიც აღინიშნება სიკვდილიანობის კოეფიციენტის ზრდა ან პროდუქტიულობის ცვლილება, გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველეს პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება. დღიური სიკვდილიანობის კოეფიციენტის ზრდის (ფრინველის გუნდის სიკვდილიანობის კოეფიციენტი > 3 ჯერ) ან დღიური კვერცხდების (>5%) ან წყლის და/ან საკვების მიღების დღიური მაჩვენებლის (>5%) შემცირების შემთხვევაში, თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს სავარაუდოდ დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა სავარაუდოდ დავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას. მუხლი 25. წესის 23-ე მუხლის პირველი პუნქტის ,,ბ“ ქვეპუნქტით განსაზღვრული ფრინველის დაუყოვნებლივ დაკვლის მიზნით ტრანსპორტირებასთან დაკავშირებული გამონაკლისები სახელმწიფო ვეტერინარის მიერ იმ საფრინველეს ინსპექტირებისას, რომელზეც გავრცელდა გამონაკლისი წესის 22–ე მუხლთან მიმართებაში, გატარებულ უნდა იქნეს შემდეგი ზომები: ა) საფრინველეს პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს ტრანსპორტირებამდე 24 საათით ადრე დაავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას; გ) რისკების შეფასების შედეგების საფუძველზე სააგენტოს მიერ სტანდარტული ნიმუშების ნაცვლად ტრანსპორტირებამდე 48 საათით ადრე, დასაკლავად გასაგზავნი თითოეული საწარმოო ერთეულის ფრინველიდან აღებული უნდა იქნეს არანაკლებ 60 ტრაქეალური/ოროფარინგეალური და/ან 60 კლოაკალური ნაცხი. მუხლი 26. წესის 25-ე მუხლის ,,ბ“ ქვეპუნქტში მითითებული HPAI-ის აფეთქებისას ფრინველის მოზარდეულის პირდაპირ ტრანსპორტირებასთან დაკავშირებული გამონაკლისები სახელმწიფო ვეტერინარის მიერ იმ კვერცხმდებელი საფრინველის ინსპექტირებისას, რომელზეც წესის 22–ე მუხლით გავრცელდა გამონაკლისი, გატარებულ უნდა იქნეს შემდეგი ზომები: ა) საფრინველის ჯანმრთელობისა და პროდუქტიულობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს ტრანსპორტირებამდე 24 საათით ადრე დაავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას; გ) რისკების შეფასების შედეგების საფუძველზე სააგენტოს მიერ სტანდარტული ნიმუშების ნაცვლად თითოეული საწარმოო ერთეულის ფრინველიდან ტრანსპორტირებამდე 48 საათით ადრე, აღებული უნდა იქნეს არანაკლებ 60 ტრაქეალური/ოროფარინგეალური და/ან 60 კლოაკალური ნაცხი. მუხლი 27. წესის 26-ე მუხლის პირველი პუნქტის ,,ა“ ქვეპუნქტში მითითებული HPAI-ის აფეთქებისას საინკუბაციო და სუფრის კვერცხის პირდაპირ ტრანსპორტირებასთან დაკავშირებული გამონაკლისები სახელმწიფო ვეტერინარის მიერ სადედე გუნდის იმ საფრინველის ინსპექტირებისას, რომელზეც გავრცელდა გამონაკლისები წესის 22–ე მუხლთან დაკავშირებით, საინკუბაციო კვერცხის პირდაპირ ტრანსპორტირებამდე გატარებულ უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება ყოველ 15 დღეში ერთხელ; გ) სტანდარტული ნიმუშები აღებული უნდა იქნეს თითოეულ საწარმოო ერთეულში. მუხლი 28. წესის 29-ე მუხლის პირველი პუნქტში მითითებული HPAI-ის აფეთქებისას გასატარებელი ზომების ხანგრძლივობა წესის მე–18-29-ე მუხლების შესაბამისად დამცავ ზონაში გამოყენებული ზომები შეწყვეტილი უნდა იქნეს დაინფიცირებულ საფრინველეში წინასწარი დასუფთავებისა და დეზინფექციის ჩატარებიდან არანაკლებ 21 დღის შემდგომ იმ პირობით, რომ: ა) დამცავ ზონაში არსებული ყველა კომერციული საფრინველე ინსპექტირებულ იქნა სახელმწიფო ვეტერინარის მიერ და ამ დიაგნოსტიკის სახელმძღვანელოს 23-ე მუხლის ,,ა“ და ,,გ“ ქვეპუნქტებით და 24-ე მუხლით გათვალისწინებული ყოველი ინსპექტირება და კლინიკური შემოწმებები დასრულდა უარყოფითი შედეგებით; ბ) დამცავ ზონაში იდენტიფიცირებული ყველა არაკომერციული საფრინველე ინსპექტირებულ იქნა სახელმწიფო ვეტერინარის მიერ და არც კლინიკური შემოწმებებისა და არც ლაბორატორიული გამოკვლევების შედეგად არ წარმოქმნილა ეჭვი ფრინველის გრიპის არსებობაზე; გ) ამ დიაგნოსტიკის სახელმძღვანელოს 23-ე მუხლის ,,დ“ ქვეპუნქტით გათვალისწინებული დამატებითი მონიტორინგი უარყოფითი შედეგებით დასრულდა. მუხლი 29. წესის 30-ე მუხლის ,,ზ“ ქვეპუნქტში მითითებული HPAI-ის აფეთქებისას საკონტროლო ზონაში გასატარებელი ზომები სახელმწიფო ვეტერინარის მიერ იმ საფრინველის ინსპექტირებისას, სადაც დაფიქსირებულია დაავადების, სიკვდილიანობის ზრდა ან პროდუქტიულობის ცვლილება, გატარებულ უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეულ საწარმოო ერთეულში კლინიკური შემოწმება, რაც აგრეთვე მოიცავს განსაკუთრებით სავარაუდოდ დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სავარაუდოდ სხვა დაავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას; გ) თითოეულ საწარმოო ერთეულში აღებული უნდა იქნეს სტანდარტული ნიმუშები. მუხლი 30. წესის 35-ე მუხლით დადგენილი გამოკვლევა სასაკლაოზე და სატრანსპორტო საშუალებებში HPAI -ზე ეჭვის შემთხვევაში სასაკლაოზე ან სატრანსპორტო საშუალებებში HPAI-ზე ეჭვის შემთხვევაში სახელმწიფო ვეტერინარის მიერ ამ ფრინველის წარმოშობის საფრინველის შესწავლისას გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში; ბ) თითოეული საწაარმოო ერთეულის შემოწმება ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკური ისტორიისა შეფასებისა და კლინიკური შემოწმებების ჩათვლით, რა დროსაც გათვალისწინებული უნდა იქნეს სასაკლაოს იმ სახელმწიფო ვეტერინარის კონსულტაციები, რომელმაც უნდა წარმოადგინოს დეტალური ინფორმაცია წინა ინსპექტირების ჩატრებისა და დაკვლამდე და დაკვლის შემდგომი შემოწმების შედეგების შესახებ; გ) ვიდრე სააგენტო მიიღებს შეტყობინებას იმის თაობაზე, რომ HPAI-ზე ეჭვი გამოირიცხა ამ მუხლის ,,ა“ და ,,ბ“ ქვეპუნქტების საფუძველზე, თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები; დ) გარდა სტანდარტული ნიმუშებისა დამატებით ლაბორატორიული გამოკვლევებისათვის წარმოდგენილი უნდა იქნეს არანაკლებ ხუთი დაავადებული, მკვდარი ან სასაკლაოზე დაკლული პათოლოგიურ ცვლილებებიანი ფრინველის ნიმუშები. მუხლი 31. წესის 36-ე მუხლის მე-2 პუნქტში მითითებული HPAI-ზე ეჭვის შემთხვევაში ან დადასტურებისას სასაკლაოზე გასატარებელი ზომები ამ დიაგნოსტიკური სახელმძღვანელოს 30-ე მუხლის ,,გ“ ქვეპუნქტით გათვალისწინებული გამოკვლევის დასრულების შემდგომ, თუ ლაბორატორიული გამოკვლევების შედეგები უარყოფითია და არ არსებობს HPAI-ზე კლინიკური ეჭვი წარმოშობის საფრინველესა და სასაკლაოზე, შესაძლებელია სააგენტომ შეწყვიტოს ზედამხედველობა. მუხლი 32. წესის 37-ე მუხლის პირველი-მე-4 პუნქტებში მითითებული HPAI-ზე ეჭვის შემთხვევაში ან დადასტურებისას სასაზღვრო საინსპექციო პუნქტში და სატრანსპორტო საშუალებებში გასატარებელი ზომები 1. სახელმწიფო ვეტერინარის მიერ იზოლაციაში მყოფი იმ ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის შემოწმებისას, რომლებიც გადმოყვანილნი იყვნენ სასაზღვრო საინსპექციო პუნქტიდან ან სატრანსპორტო საშუალებიდან HPAI-ზე ეჭვის ან მისი დადასტურებისას, გატარებული უნდა იქნეს შემდეგი ზომები: ა) შესაბამისი ჩანაწერებისა და დოკუმენტების შემოწმება, ამგვარი დოკუმენტების ან ჩანაწერების არსებობის შემთხვევაში; ბ) იზოლაციაში მყოფი ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკური შემოწმება და სხვა დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა დაავადებული ფრინველის კლინიკური შემოწმება; გ) სტანდარტული ნიმუშები აღებული უნდა იქნეს სხვადასხვა სატრანსპორტო საშუალებების ყუთებში ან გალიებში განთავსებული ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველიდან. 2. ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის დაკვლის შემთხვევაში სახელმწიფო ვეტერინარის მიერ იდენტიფიცირებულ წარმოშობის საფრინველეს ინსპექტირებისას გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკური ისტორიის შეფასებისა და კლინიკური შემოწმებების ჩათვლით, რა დროსაც გათვალისწინებული უნდა იქნეს სასაკლაოს იმ სახელმწიფო ვეტერინარის კონსულტაციები, რომელმაც უნდა წარმოადგინოს დეტალური ინფორმაცია წინა შემოწმების ჩატარებისა და დაკვლამდე და დაკვლის შემდგომი შემოწმების შედეგების შესახებ; გ) ვიდრე სააგენტო მიიღებს შეტყობინებას იმის თაობაზე, რომ საეჭვო აფეთქება გამოირიცხა ამ პუნქტის ,,ა“ და „ბ“ ქვეპუნქტების საფუძველზე, თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები; დ) გარდა სტანდარტული ნიმუშებისა, დამატებით ლაბორატორიული გამოკვლევებისათვის წარმოდგენილი უნდა იქნეს არანაკლებ ხუთი დაავადებული, მკვდარი ან სასაკლაოზე დაკლული პათოლოგიურ ცვლილებებიანი ფრინველის ნიმუშები; ე) ამ პუნქტის ,,გ“ და ,,დ“ ქვეპუნქტებით გათვალისწინებული გამოკვლევის დასრულების შემდგომ, თუ ლაბორატორიული გამოკვლევების შედეგები უარყოფითია და არ არსებობს HPAI-ზე კლინიკური ეჭვი წარმოშობის საფრინველესა და სასაკლაოზე, შესაძლებელია სააგენტომ შეწყვიტოს ზედამხედველობა. მუხლი 33. წესის 39-ე მუხლის მე-8 პუნქტის ,,ბ“ და ,,თ“ ქვეპუნქტებში მითითებულ საფრინველეში LPAI-ის დადასტურებისას გასატარებელი ზომები ფრინველის სასაკლაოზე ტრანსპორტირებამდე, სახელმწიფო ვეტერინარის მიერ საფრინველის ან ფრინველის გამოსაჩეკ საფრინველის ინსპექტირებისას, სადაც ფრინველი გამოიჩეკა დაავადების საინკუბაციო პერიოდის განმავლობაში შეგროვებული კვერცხიდან, გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკური ისტორიის შეფასებასა და კლინიკურ შესწავლას; გ) სტანდარტული ნიმუშები აღებული უნდა იქნეს სასაკლაოზე გაგზავნამდე არანაკლებ 48 საათით ადრე თითოეული საწარმოო ერთეულის ფრინველიდან; დ) სტანდარტული ნიმუშები აღებული უნდა იქნეს თითოეული საწარმოო ერთეულის იმ ფრინველიდან, რომლებიც გამოიჩეკნენ დაავადების საინკუბაციო პერიოდში შეფროვებული კვერცხიდან. მუხლი 34. წესის მე-40 მუხლის მე-2 პუნქტის ,,ბ“ ქვეპუნქტით განსაზღვრულ ზოგიერთ საფრინველესთან დაკავშირებული გამონაკლისები LPAI-ის დადასტურებისას სახელმწიფო ვეტერინარის მიერ იმ საფრინველის ინსპექტირებისას, რომელზეც დაწესებულია გამონაკლისები წესის 39-ე მუხლის მე-2 და მე-3 პუნქტებთან და 39-ე მუხლის მე-7 პუნქტის ,,ბ“ ქვეპუნქტთან მიმართებაში, გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში; ბ) თითოეულ საწარმოო ერთეულის რეგულარული კლინიკური შემოწმება, რაც აგრეთვე მოიცავს კლინიკური ისტორიის შეფასებასა და დაავადებული ფრინველისა და ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკურ შემოწმებას; გ) LPAI-ის ბოლო გამოვლენიდან 21 დღის შემდეგ, სულ მცირე 21 დღიანი ინტერვალის გათვალისწინებით ლაბორატორიული გამოკვლევების მიზნებისათვის სტანდარტული ნიმუშების ნაცვლად აღებული უნდა იქნეს შემდეგი ნიმუშები: გ.ა) ადგილზე არსებული მკვდარი ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა მკვდარი ფრინველიდან ნიმუშების აღება; გ.ბ) ტრაქეალური/ოროფარინგეალური ან კლოაკალური ნაცხი აღებულ უნდა იქნეს სულ მცირე 60 ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველიდან; 60 ფრინველზე ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველზე ნაკლების შემთხვევაში ნაცხი აღებულ უნდა იქნეს არსებული რაოდენობიდან; იმ შემთხვევაში, თუ ფრინველი მცირე ზომისაა, ეგზოტიკურია და თუ მათთან შეხება საშიშია ადამიანებისათვის, ნიმუშები შეგროვებული უნდა იქნეს ახლად გამოყოფილი ექსკრემენტებიდან; გ.გ) თუმცა, რისკის შეფასების საფუძველზე სააგენტოს მიერ შესაძლოა დაშვებულ იქნეს გამონაკლისები ამ მუხლის ,,გ.ა“ და ,,გ.ბ“ ქვეპუნქტებით დადგენილ ნიმუშების რაოდენობაზე; დ) ამ მუხლის ,,გ“ ქვეპუნქტით გათვალისწინებული ნიმუშების აღება და ლაბორატორიული გამოკვლევა უნდა გაგრძელდეს ორი თანმიმდევრული უარყოფითი შედეგის მიღებამდე, რომელთა შორის ინტერვალი უნდა იყოს არანაკლებ 21 დღე. მუხლი 35. წესის 42-ე მუხლის პირველი და მე-4 პუნქტებით განსაზღვრული LPAI-ის დადასტურებისას კონტაქტურ საფრინველეში გასატარებელი ზომები სახელმწიფო ვეტერინარის მიერ კონტაქტურ საფრინველის ინსპექტირებისას გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება, ასეთის არსებობის შემთხვევაში; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს სავარაუდოდ დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სავარაუდოდ სხვა დაავადებული ფრინველის ჯანმრთელობის მდგომარეობის შესწავლასა და კლინიკური ისტორიის შეფასებას; გ) სტანდარტული ნიმუშები აღებული უნდა იქნეს თითოეული საწარმოო ერთეულიდან ან მოკლული ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა მოკლული ფრინველიდან. მუხლი 36. წესის 44-ე მუხლის პირველი პუნქტის ,,ბ“ ქვეპუნქტით განსაზღვრული LPAI-ის აფეთქებისას შეზღუდულ ზონაში გასატარებელი ზომები სახელმწიფო ვეტერინარის მიერ შეზღუდულ ზონაში კომერციული საფრინველის ინსპექტირებისას გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის კლინიკური ისტორიის შეფასებას და კლინიკურ შესწავლას; გ) სტანდარტული ნიმუშები აღებული უნდა იქნეს თითოეულ საწარმოო ერთეულში; დ) სამიზნე საფრინველეში, კომპარტმენტში ან საწარმოო ერთეულებში კლინიკური ინსპექტირებით და ლაბორატორიული ნიმუშების აღებით დამატებითი სახელმწიფო მონიტორინგის განხორციელება სააგენტომ უნდა გადაწყვიტოს რისკის შეფასების შედეგების საფუძველზე. მუხლი 37. წესის 45-ე მუხლის ,,ა“ და ,,ბ“ ქვეპუნქტებში მითითებული LPAI-ის აფეთქებისას გასატარებელი ზომების ხანგრძლივობა წესის 43-ე-46-ე მუხლების შესაბამისადი შეზღუდულ ზონაში გამოყენებული ზომები შეწყვეტილი უნდა იქნეს დაინფიცირებულ საფრინველეში დეპოპულაციის, წინასწარი დასუფთავებისა და დეზინფექციის ჩატარებიდან არანაკლებ 21 დღის შემდგომ ან LPAI-ის დადასტურებიდან არანაკლებ 42 დღის შემდგომ იმ პირობით, რომ: ა) შეზღუდულ ზონაში არსებული ყველა კომერციული საფრინველე შემოწმებულია სახელმწიფო ვეტერინარის მიერ, ჩატარებულია ამ დიაგნოსტიკის სახელმძღვანელოს 30-ე მუხლის ,,გ“ და ,,დ“ ქვეპუნქტებით გათვალისწინებული ყველა ნიმუში გამოკვლეულია და გამოკვლევის შედეგები ხელმისაწვდომია; ბ) ხელმისაწვდომია LPAI-ის გავრცელების რისკის განსაზღვრისათვის ნებისმიერი დამატებითი კლინიკური შემოწმებისა და ლაბორატორიული გამოკვლევების შედეგები, რომელიც შესაძლოა მოიცავდეს არაკომერციულ საფრინველესაც; გ) LPAI-ის გავრცელების რისკის შეფასების საფუძველზე, ეპიდემიოლოგიური მდგომარეობისა და ამ მუხლის ,,ა“ და ,,ბ“ ქვეპუნქტებში მითითებული ლაბორატორიული გამოკვლევების შედეგების გათვალისწინებით სააგენტო მიიჩნევს დამაკმაყოფილებლად. ამგვარი შეფასების საფუძველზე შეიძლება დავასკვნათ, რომ დადებითი სეროლოგიური და უარყოფითი ვირუსოლოგიური გამოკვლევების შედეგების შემთხვევაში შეზღუდვები შეიძლება გაუქმდეს. მუხლი 38. წესის 47-ე მუხლის პირველი და მე-4 პუნქტის ,,ა“ ქვეპუნქტით განსაზღვრულ ღორებსა და სხვა სახეობის ცხოველებთან დაკავშირებული ზომები და ლაბორატორიული გამოკვლევები სახელმწიფო ვეტერინარის მიერ ღორის სადგომის ინსპექტირების შემდგომ ფრინველის გრიპის დადასტურების შემთხვევაში გატარებული უნდა იქნეს შემდეგი ზომები: ა) სადგომის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება, ამგვარის არსებობის შემთხვევაში; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს დაავადებული ღორის კლინიკური ისტორიის შეფასებას ან კლინიკურ შესწავლას; გ) თითოეული საწარმოო ერთეულიდან არანაკლებ 60 ღორის ან სადგომში 60 ღორზე ნაკლების არსებობის შემთხვევაში თითოეული ღორის ნაზალურ/ოროფარინგეალური ნაცხი აღებული უნდა იქნეს დაინციფირებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის გამოწუნებამდე ან იმავე დღეს. ღორიდან აღებული უნდა იქნეს სისხლის არანაკლებ 60 ნიმუში ზემოაღნიშნული გამოწუნების დღიდან ორიდან ოთხ კვირამდე პერიოდში. ნიმუშები შეგროვებული უნდა იქნეს ისე, რომ არანაკლებ ერთი ნიმუში მაინც წარმოდგენილი იქნეს ღორის იმ ჯგუფიდან, რომელსაც უშუალო შეხება ჰქონდათ ერთმანეთთან; დ) ღორის ერთი სადგომიდან მეორე სადგომში გადაყვანა შეიძლება იქნეს ავტორიზებული იმ შემთხვევაში, თუ ფრინველის გრიპის აღმოჩენიდან 14 დღის შემდგომ თითოეული საწარმოო ერთეულის ღორიდან არანაკლებ 60 ნაზალურ/ოროფარინგეალური ნაცხის და სისხლის 60 ნიმუშის გამოკვლევა უარყოფითი შედეგებით დასრულდა; ე) სასაკლაოზე ღორის გადაყვანა შეიძლება იქნეს ავტორიზებული იმ შემთხვევაში, თუ ფრინველის გრიპის აღმოჩენიდან 14 დღის შემდგომ თითოეული საწარმოო ერთეულიდან არანაკლებ 60 ნაზალურ/ოროფარინგეალური ნაცხის გამოკვლევა უარყოფითი შედეგებით დასრულდა. საეჭვო ან დადებითი ლაბორატორიული შედეგების შემთხვევაში ნებისმიერი შემდგომი გამოკვლევა საჭიროა ღორებში ფრინველის გრიპის ინფექციის ან ტრანსმისიის გამოსარიცხად; ვ) თუ სახელმწიფო ვეტერინარს გააჩნია ეჭვი, რომ სადგომის სხვა იდენტიფიცირებულ ძუძუმწოვრებს, რომლებიც ამთვისებელნი არიან H5 და H7 ქვეტიპის ფრინველის გრიპისა და შესაძლოა კონტაქტი ჰქონდათ დაინფიცირებულ ფრინველთან ან ჩაკეტილ სივრცეში მყოფ სხვა დაინფიცირებულ ფრინველთან, აღებული უნდა იქნეს ნიმუშები ლაბორატორიული გამოკვლევებისათვის. მუხლი 39. წესის 49-ე მუხლის მე-3 პუნქტის ,,ბ“ და ,,გ“ ქვეპუნქტებით გათვალიწინებული საფრინველის რეპოპულაცია სახელმწიფო ვეტერინარის მიერ, კომერციული რეპოპულირებული საფრინველის ინსპექტირებისას, გატარებული უნდა იქნეს შემდეგი ზომები: ა) საფრინველის პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა დაავადებული ფრინველის კლინიკური ისტორიის შეფასებას და კლინიკური შესწავლას; გ) სტანდარტული ნიმუშების ნაცვლად თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს შემდეგი ნიმუშები: გ.ა) ფრინველის საფრინველეში განთავსებისთანავე სისხლის არანაკლებ 20 ნიმუში, გარდა ერთდღიანი წიწილისა; ნიმუშების აღება, შესაძლებლობის ფარგლებში, უნდა განხორციელდეს ფრინველის წარმოშობის საფრინველეში, ახალ საფრინველეში რეპოპულაციის მიზნით გადაყვანამდე; გ.ბ) მკვდარი ფრინველის ნიმუშები ან არაუმეტეს 10 მკვდარი ფრინველის ლეშიდან აღებული ნაცხი რეპოპულაციის თარიღიდან ყოველ კვირა 21 დღის განმავლობაში; დ) თუ საფრინველე წარსულში დაინფიცირებული იყო HPAI-ის გამომწვევი ვირუსით, თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს წყლის ფრინველის (ბატი/იხვი) 20 ტრაქეალურ/ოროფარინგეალური და 20 კლოაკალური ნაცხი და თუ შესაძლებელია, აღნიშნული უნდა განხორციელდეს რეპოპულაციის თარიღიდან 21 დღიანი პერიოდის ბოლო კვირას; ე) თუ საფრინველე წარსულში დაინფიცირებული იყო LPAI-ის გამომწვევი ვირუსით, თითოეული საწარმოო ერთეულიდან აღებული უნდა იქნეს წყლის ფრინველის (ბატი/იხვი) 20 ტრაქეალურ/ოროფარინგეალური და 20 კლოაკალური ნაცხი და სისხლის 20 ნიმუში. მუხლი 40. წესის 55-ე მუხლის მე-4 პუნქტის ,,ი“ ქვეპუნქტით დადგენილი ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის პროფილაქტიკური ვაქცინაცია და პროფილაქტიკური ვაქცინაციის გეგმის დამტკიცება 1. წესის 52-ე-55-ე მუხლებით განსაზღვრული ლაბორატორიული გამოკვლევები ვაქცინირებულ ფრინველში ან ჩაკეტილ სივრცეში მყოფ სხვა ფრინველში უნდა განხორციელდეს აღიარებული DIVA რეაგენტით, თუ ცნობილია საველე ვირუსი. 2. ინდიკატორული ფრინველის გამოყენების შემთხვევაში, ფრინველი წარმოდგენილი უნდა იქნეს თითოეული ვაქცინირებული გუნდიდან, უნდა მოხდეს მათი კლინიკური შემოწმება და გამოკვლევა HI ტესტის გამოყენებით. თითოეულ ვაქცინირებულ ჯგუფში ინდიკატორული ფრინველის სისხლის 20 ანალიზი აღებული უნდა იქნეს არანაკლებ 60 დღეში ერთხელ. მუხლი 41. წესის 57-ე მუხლით დადგენილი გადაუდებელი ვაქცინაციისას ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის და ფრინველის პროდუქტების გადაადგილებასთან დაკავშირებული მოთხოვნები 1. ფრინველის გრიპის ინფექციის გავრცელების რისკის მინიმუმამდე შემცირების მიზნით, ცოცხალი ფრინველის და ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის, ასევე მათი კვერცხის გადაადგილებისას, დაწესებულ უნდა იქნეს მკაცრი მონიტორინგი. 2. ამ მუხლის პირველი პუნქტით განსაზღვრული მიზნებისათვის, ვაქცინაციის ზონაში და მის ფარგლებს გარეთ ფრინველის გრიპის ინფექციის გავრცელების რისკის მინიმუმამდე შემცირების მიზნით გადაუდებელი ვაქცინაციის კამპანიის დასაწყისში ცოცხალი ფრინველის და ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის, ასევე მათი კვერცხის გადაადგილებასთან დაკავშირებით დაწესებული უნდა იქნეს მკაცრი მონიტორინგი: ა) ვაქცინაციის ზონაში ან მის გარეთ საინკუბაციო და სუფრის კვერცხის პირველ გადაადგილებამდე და აღნიშნულის შემდგომ არანაკლებ 30 დღეში ერთხელ სახელმწიფო ვეტერინარის მიერ გატარებული უნდა იქნეს ქვემოთ ჩამოთვლილი ზომებიდან ერთ-ერთი: ა.ა) არავაქცინირებული სადედე ან კვერცხმდებელი ფრინველის კლინიკური შემოწმება თითოეულ საწარმოო ერთეულში, რაც თავის მხრივ მოიცავს ფრინველის, განსაკუთრებით კი დაავადებული ფრინველის კლინიკური ისტორიის შეფასებასა და კლინიკურ შემოწმებას; თითოეული საწარმოო ჯგუფიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები; ა.ბ) ვაქცინირებული სადედე ან კვერცხისმდებელი ფრინველის კლინიკური შემოწმება თითოეულ საწარმოო ერთეულში, რაც თავის მხრივ მოიცავს ამ გუნდში არსებულ ინდიკატორული ფრინველის კლინიკური ისტორიის შეფასებასა და კლინიკურ შემოწმებას; ამ ინდიკატორული ფრინველიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები. ბ) ცოცხალი ვაქცინირებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველის სხვა საფრინველეში ან ცოცხალი ვაქცინირებული ფრინველის ვაქცინაციის ზონაში ან მის ფარგლებს გარეთ გადაადგილებისათვის სახელმწიფო ვეტერინარის მიერ გატარებული უნდა იქნეს შემდეგი ზომები: ბ.ა) საფრინველეს პროდუქტიულობისა და ჯანმრთელობის ამსახველი ჩანაწერების შემოწმება; ბ.ბ) თითოეული საწარმოო ერთეულის კლინიკური შემოწმება, რაც აგრეთვე მოიცავს დაავადებული ფრინველის ან ჩაკეტილ სივრცეში მყოფი სხვა დაავადებული ფრინველის კლინიკური ისტორიის შეფასებასა და კლინიკურ შესწავლას გადაადგილებამდე 72 საათით ადრე; განსაკუთრებული ყურადღება უნდა დაეთმოს ინდიკატორულ ფრინველს; ბ.გ) თუ შემოწმების, კლინიკური შემოწმების და ამ პუნქტის ,,ბ.ა“ და ,,ბ.ბ“ ქვეპუნქტებით დადგენილი შემოწმების შედეგები არ არის დამაკმაყოფილებელი, ინდიკატორულ ფრინველიდან აღებული უნდა იქნეს სტანდარტული ნიმუშები; იმ შემთხვევაში, თუ შემოწმების შედეგები დამაკმაყოფილებელია, აღებული უნდა იქნეს შემდეგი ნიმუშები: ბ.გ.ა) გადაადგილებამდე 72 საათით ადრე ვაქცინირებული ფრინველიდან ან ჩაკეტილ სივრცეში მყოფი სხვა ფრინველიდან აღებული უნდა იქნეს არანაკლებ 20 ტრქეალურ/ოროფარინგეალური და 20 კლოაკალური ნაცხი, აგრეთვე სისხლის 20 ნიმუში DIVA შესაბამისი რეაგენტის გამოყენებით; ბ.გ.ბ) გადაადგილებამდე ინდიკატორული ფრინველიდან აღებული უნდა იქნეს 20 ტრქეალური/ოროფარინგეალური და 20 კლოაკალური ნაცხი, აგრეთვე სისხლის 20 ნიმუში და გამოყენებული უნდა იქნეს HI გამოკვლევის მეთოდი. თავი V ვირუსოლოგიური გამოკვლევა და შედეგების შეფასება მუხლი 42.ზოგადი დებულება მოლეკულურ დონეზე დიაგნოსტიკის შემუშავებამდე და დანერგვამდე, ფრინველის გრიპის გამომწვევი ვირუსის ყველაზე მგრძნობიარე დიაგნოსტიკურ ტესტად მიიჩნეოდა ვირუსის გამოყოფა ქათმის კვერცხის ემბრიონის ინოკულაციით, რაც მნიშვნელოვანი იყო დამაინფიცირებელი ვირუსის შემდგომი იდენტიფიცირებისა და დახასიათებისათვის. დიაგნოსტიკის განვითარების მნიშვნელოვანი ეტაპები წარმოდგენილია ამ თავში. მუხლი 43. ნიმუშების დამუშავება 1. „მშრალ“ მდგომარეობაში წარმოდგენილი ნაცხი სრულად უნდა იქნეს მოთავსებული ანტიბიოტიკურ არეში. შესაძლებელია ნიმუშების გაერთიანება ხუთ პარტიად იმ პირობით, რომ ნიმუშები აღებულია ერთი და იგივე სახეობიდან, ერთსა და იმავე დროს და ერთსა და იმავე ეპიდემიოლოგიურ ერთეულში. 2. ფრინველის გრიპისა დიადნოსტიკაზე მომუშავე ლაბორატორიისათვის მიწოდებული ლეში უნდა დათვლიერდეს და აღებული იქნეს შემდეგი ორგანოების ნიმუშები: ფეკალიები ან ნაწლავების შიგთავსი, ტვინის ქსოვილი, ტრაქეა, ფილტვები, ღვიძლი, ელენთა და სხვა თვალსაჩინოდ დაზიანებული ორგანოები. შესაძლებელია ორგანოებისა და ქსოვილების გაერთიანება, თუმცა აუცილებელია ფეკალური მასალის ცალკე დამუშავება. 3. უნდა განხორციელდეს ფეკალიების ნიმუშებისა და ორგანოების ჰომოგენიზაცია (ბლენდერში ან ფილთაქვისა და სტერილური ქვიშის გამოყენებით) ანტიბიოტიკურ არეში და 10–დან 20–მდე% w/v სუსპენზიის შექმნა. 4. იმერსიული ნაცხი და სუსპენზია დაახოლებით ორი საათის განმავლობაში მოთავსებული უნდა იქნეს ოთახის ტემპერატურაზე (ან 4oC ტემპერატურაზე, გაცილებით მეტი დროის განმავლობაში) და შემდგომ უნდა განხორციელდეს გასუფთავება ცენტრიფუგირების გზით (მაგალითად: 800–დან 1 000 ბრ – მდე 10 წუთის განმავლობაში). მუხლი 44. ვირუსის გამოყოფა ქათმის კვერცხის ემბრიონიდან 1. გასუფთავებული სითხე 0,1–დან 0,2 მლ ოდენობით შეყვანილი უნდა იქნეს ინკუბატორში 9-დან 11 დღემდე განთავსებულ, არანაკლებ ოთხი განაყოფიერებული კვერცხის თითოეულ ალანტოისურ ღრუში. აღნიშნული კვერცხი მიღებული უნდა იქნეს SPF გუნდიდან, თუმცა შესაძლებელია ფრინველის გრიპის ანტისხეულებზე თავისუფალი (ანტისხეულებზე უარყოფითი შრატი - SAN) გუნდიდან მოპოვებული კვერცხის გამოყენებაც. 2. ინოკულირებული კვერცხი შენახული უნდა იქნეს 37oC-ზე და უნდა გადიოდეს ყოველდღიურ ოვოსკოპირებას. მკვდარი ან მომაკვდავი ჩანასახიანი კვერცხი და სხვა დანარჩენი კვერცხი ინოკულაციიდან 6 დღის შემდგომ უნდა გაცივდეს 4oC-ზე და ალანტოისურ–ამნიონური სითხეები შემოწმდეს ჰემაგლუტინაციის აქტივობაზე. თუ ადგილი არ აქვს ჰემაგლუტინაციას, აღნიშნული პროცედურა განმეორებით უნდა იქნეს ჩატარებული გაუზავებელი ალანტოიდურ/ამნიონური სითხის გამოყენებით, როგორც ინოკულუმი. ჰემაგლუტინაციის გამოვლენის შემთხვევაში, უნდა გამოირიცხოს ბაქტერიის არსებობა ხელოვნურ საკვებ ნიადაგებზე ჩათესვით. ბაქტერიის არსებობის შემთხვევაში, სითხის გადაცემა შესაძლოა განხორციელდეს 450 მმ მემბრანული ფილტრის გამოყენებით, რის შემდგომაც ემატება ანტიბიოტიკები და ხორციელდება ინოკულაცია განაყოფიერებულ კვერცხში. 3. დიაგნოზის დაჩქარების მიზნით, ზოგიერთი ლაბორატორია იყენებს ორ- სამ-დღიან ან ორდღიან და ოთხდღიან პასაჟებს და წარადგენს ორ ექვსდღიან პასაჟთან შედარებითი შედეგების ანგარიშს, თუმცა აღნიშნული ჯერჯერობით არ არის სრულად შეფასებული. 4. პოზიტიური სითხე შემოწმებული უნდა იქნეს, რომ ის არ შეიცავს ბაქტერიებს. ბაქტერიის არსებობის შემთხვევაში შესაძლებელია სითხის გადაცემა 450 მმ მემბრანული ფილტრის გამოყენებით ან ცენტრიფიგურებით, ბაქტერიის მოშორების მიზნით და უნდა იქნეს რეპასაჟირებული კვერცხში მეტი ანტიბიოტიკების დამატების შემდგომ. მუხლი 45. დიფერენციული დიაგნოსტიკა 1. წინასწარი დიფერენცირება მნიშვნელოვანია ფრინველის გრიპის გამომწვევი ვირუსის გავრცელების შესამცირებელი საკონტროლო ზომების შეძლებისდაგვარად სწრაფად განხორციელებისათვის, ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიამ, რომელმაც განახორციელა ჰემაგლუტინაციით ვირუსის გამოყოფა, უნდა შეძლოს H5 ან H7 ქვეტიპის გრიპის A ვირუსის ან ნიუკასლის დაავადების გამომწვევი ვირუსის გარჩევა. ჰემაგლუტინირებადი სითხეები გამოყენებული უნდა იქნეს HI ტესტისთვის, ისე როგორც ეს აღწერილია ამ დიაგნოსტიკის სახელმძღვანელოს მე–9 თავში. დადებითი ინჰიბირება, მსგავსად პოზიტივ კონტროლის ტიტრისა 2-3 log2–მდე, A ტიპის გრიპის H5 ან H7 ქვეტიპისთვის სპეციფიკური პოლიკლონური ანტიშრატით, უზრუნველყოფს წინასწარ იდენტიფიკაციას, რაც მოგვცემს შუალედური საკონტროლო ღონისძიებების გატარების შესაძლებლობას. 2. გრიპის შტამების ქვეტიპის დამადასტურებელი იდენტიფიკაციისათვის გრიპის ვირუსის H16 ქვეტიპისა და N9 ქვეტიპის არსებობისა და ვარიაციების გამო, ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიის მიერ დამხმარე ანტიშრატის შენახვა არც პრაქტიკულია და არც ეკონომიურად ეფექტური. თუმცა, ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიამ: ა) ანტიგენების ჯგუფების აღმოჩენის მიზნით გაორმაგებული იმუნოდიფუზიის ტესტის მეშვეობით უნდა დაადასტუროს, რომ იზოლატი წარმოადგენს A ტიპის გრიპის გამომწვევ ვირუსს; ბ) განსაზღვროს არის თუ არა იზოლატი H5 ან H7 ქვეტიპის და აღმოჩენის შემთხვევაში საჭიროა თუ არა H5 და H7 ქვეტიპის LPAI–თან დაკავშირებული საკონტროლო ზომების დანერგვა; გ) შემდგომი დადასტურებისა და სრული დახასიათებისათვის უზრუნველყოს H5 და H7 ქვეტიპის HPAI-ის ვირუსის იზოლატების დაუყოვნებლივი მიწოდება რეფერენს ლაბორატორიისათვის, გარდა ამ პუნქტის ,,დ“ ქვეპუნქტით გათვალისწინებული გამონაკლისების; დ) დამატებით, შესაბამისი აღჭურვილობის მქონე ლაბორატორიებში სასურველია ინტრავენური პათოგენურობის ინდექსის გამოკვლევის ჩატარება ექვსი კვირის ასაკის წიწილებში, ამ დიაგნოსტიკის სახელმძღვანელოს მე–8 თავით დადგენილი მოთხოვნების შესაბამისად. 1,2–ზე მაღალი მაჩვენებლის შემთხვევაში, ინტრავენური პათოგენურობის ინდექსი მიუთითებს ვირუსის არსებობაზე და საჭიროა HPAI-ზე კონტროლის ზომების სრული გატარება. 3. ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიების მიერ ადგილზე აგრეთვე გათვალისწინებული უნდა იქნეს ექსპერტიზისთვის საჭირო აპარატურა, რომლის მეშვეობითაც შესაძლებელი იქნება ჰემაგლუტინინის გენის ნუკლეოტიდური სექვენირება და, რაც თავის მხრივ, განკუთვნილია H5 ან H7 LPAI-ის გამომწვევი ვირუსის ჰემაგლუტინინის პრეკურსორის პროტეინის გახლეჩვის ადგილზე მრავლობითი ძირითადი ამინომჟავების არსებობის დასადგენად. მიუხედავად იმისა, რომ რეფერენს ლაბორატორიის მიერ პათოგენურობის განსაზღვრას ენიჭება განსაკუთრებული პრიორიტეტი, ეროვნულ დონეზე ვირუსის ამგვარი დახასიათება მნიშვნელოვნად შეამცირებს დიაგნოზისათვის განსაზღვრულ დროს და დადებით შემთხვევაში, HPAI-ზე საწინააღმდეგო ზომების გატარების დროს. 4. საჭიროების შემთხვევაში, იზოლატის კლასიფიცირებისა და დახასიათებისათვის, ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიიდან, შემდგომი ანტიგენური ან გენეტიკური შესწავლის მიზნით, ჰემაგლუტინაციის შედეგად გამოყოფილი ყველა ვირუსი უნდა გადაიგზავნოს რეფერენს ლაბორატორიაში. 5. რეფერენს ლაბორატორია ახორციელებს მიღებული გრიპის ვირუსის სრულ ანტიგენურ ტიპირებას. H5 და H7 ვირუსების შემთხვევაში, რომელთა ინტრავენური პათოგენურობის ინდექსი არ აღემატება 1,2 მაჩვენებელს, საჭიროა ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიაში ჰემაგლუტინინის პრეკურსორის პროტეინის გახლეჩვის საიტში ძირითადი ამინომჟავების მრავალჯერადობის დასადგენად, ჰემაგლუტინინის გენის ნუკლეოტიდური სექვენირება და შედეგების მიღებისთანავე ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიისა და კომპეტენტური ორგანოების ინფორმირება, რის საფუძველზეც შესაძლებელი გახდება HPAI-ის საწინააღმდეგო ზომების სრულად გატარება. თავი VI მოლეკულური დიაგნოსტიკა და შედეგების შეფასება მუხლი 46. ზოგადი დებულება 1. HPAI-ის მიმდინარე განსაზღვრება იძლევა ვირულენტობის ფაქტორების მოლეკულური იდენტიფიცირების შესაძლებლობას და ადასტურებს ფრინველის გრიპის დიაგნოსტიკაში მოლეკულური ტექნიკის გამოყენებას. ბოლო დროს აღნიშნულის გამოყენება დანერგილი იქნა უშუალოდ დაინფიცირებული კლინიკური ნიშნების მქონე ფრინველის ნიმუშებში ფრინველის გრიპის ვირუსის გამოვლენისა და დახასიათებისათვის. კლინიკურ ნიმუშებთან დაკავშირებით გამოყენებული RT-PCR ტრადიციული ტექნიკა სწორად განსაზღვრული პარამეტრებით იწვევს სწრაფ გამოვლენასა და ქვეტიპის (სულ მცირე H5 და H7) იდენტიფიცირებას, PCR ამპლიკონური პროდუქტის ჩათვლით, რაც შესაძლოა გამოყენებული იქნეს ნუკლეოტიდების თანმიმდევრობისათვის და დაინფიცირებული შენობების აღმოჩენისას აღნიშნულის გამოყენება მნიშვნელოვანია შესაბამისი აფეთქებების სწრაფად იდენტიფიცირებისათვის. ფრინველის ვირუსის გამოვლენისას და კლინიკურ ნიმუშებში H5 ან H7 ქვეტიპის განსაზღვრისას ფლუროგენული ზონდის სისტემების გამოყენებით „რეალური დროის“ ერთსაფეხურიანი RT-PCR იძლევა გაცილებით სწრაფი და მგრძნობიარე დიაგნოზის შესაძლებლობას. 2. RT-PCR და rRT-PCR სისტემებთან დაკავშირებულ მნიშვნელოვან პრობლემას წარმოადგენს ის, რომ დღეისათვის სხვადასხვა ლაბორატორიების მიერ შემუშავებული იქნა სხვადასხვა სისტემები და მიუხედავად კანონიერებისა, აღნიშნული კვლავაც არ არის ვალიდირებული და იგი არ ექვემდებარება სხვადასხვა ლაბორატორიებში დიდი რაოდენობით ნიმუშების ტესტირებას. თუ დიაგნოსტიკური პარამეტრები, როგორიცაა ციკლური პერიოდი და გაშვების დრო, განსხვავდებიან შესაბამისი პროტოკოლებით რეკომენდებული პარამეტრებიდან, ამ დიაგნოსტიკის სახელმძღვანელოს მე-3 მუხლის მე-3 პუნქტის შესაბამისად გამოყენებამდე დემონსტრირებული უნდა იქნეს მათი შესაბამისობა შემდგომი გამოყენების მიზნით. თავი VII In vivo პათოგენურობის ტესტი და შედეგების შეფასება მუხლი 47. ზოგადი დებულებები 1. ქათმებში, ფრინველიდან იზოლირებული A ტიპის გრიპის გამომწვევი ვირუსის ვირულენტობის შეფასებისთვის, საჭიროა ინტრავენური პათოგენურობის ტესტის ჩატარება, შემდეგი თანმიმდევრობით: ა) ახლად დაინფიცირებული ალანტოისური სითხე HA ტიტრით >1/16 (>24 ან >log24 იმ შემთხვევაში, თუ აღნიშნული გამოხატულია როგორც ეკვივალენტური), რაც შეიძლება დაბალი პასაჟირების დონით, საწყისი გამოყოფით შერჩევის გარეშე, განზავებული უნდა იქნეს 1/10 სტერილურ იზოტონურ ხსნარში; ბ) 0,1 მლ გაზავებული ვირუსის ინტრავენური ინექცია ხორციელდება ექვსი კვირის ასაკის ათივე SPF ან SAN წიწილებში; გ) ფრინველების შემოწმება მიმდინარეობს 10 დღის განმავლობაში 24 საათიანი ინტერვალით. ყოველი დაკვირვებისას, თითოეული ფრინველის შეფასება ხორციელდება შემდეგნაირად: გ.ა) 0 ქულა ჩვეულებრივი მდგომარეობის შემთხვევაში, 1 – დაავადების შემთხვევაში, 2 – მძიმედ დაავადების შემთხვევაში, 3 – სიკვდილის შემთხვევაში. დაავადებული და მძიმედ დაავადებული ფრინველის გარჩევა ექვემდებარება სუბიექტურ კლინიკურ შეფასებას; გ.ბ) ჩვეულებრივ, „დაავადებულ“ ფრინველს აღენიშნება ერთ–ერთი, ხოლო „მძიმედ დაავადებულ“ ფრინველს კი რამდენიმე შემდეგი კლინიკური ნიშნები: რესპირატორული გართულებები, სისუსტე, დიარეა, კანის ან საყურეების ციანოზი, სახის და/ან თავის შეშუპება, ნერვული ნიშნები. მკვდარი ფრინველის შეფასება უნდა განხორციელდეს 3 ქულით ფრინველის სიკვდილის შემდგომ დაკვირვების დარჩენილი დღეების განმავლობაში. გ.გ) ფრინველის დაავადების დროს, როდესაც ისინი ვერ იღებენ საკვებს და სასმელს, უნდა მოხდეს მათი მოკვლა ჰუმანური მეთოდით და შემდგომი შეფასებისას აღნიშნული ფრინველი შეფასდება, როგორც მკვდარი ფრინველი, ვინაიდან ისინი მოკვდებიან 24 საათის განმავლობაში ყოველგვარი ჩარევის გარეშეც. დ) ინტრავენური პათოგენობის ინდექსი წარმოადგენს 10 დღიანი პერიოდის განმავლობაში თითოეული ფრინველის შეფასების საშუალო ქულას. ინდექსი 3,00 ნიშნავს იმას, რომ ყოველი ფრინველი მოკვდა 24 საათის განმავლობაში, ხოლო ინდექსი 0,00 აღნიშნავს იმას, რომ 10 დღიანი დაკვირვების პერიოდში არცერთ ფრინველს არ აღენიშნებოდა კლინიკური ნიშნები. 2. დანართში №2 წარმოდგენილია „შედეგების ჩაწერისა და ინდექსების გამოთვლის მარტივი მეთოდები“. თავი VIII სეროლოგიური გამოკვლევა და შედეგების შეფასება მუხლი 48. ზოგადი დებულება 1. ფრინველის გრიპის A ვირუსის გამოვლენის მეთოდი ეფუძნება გრიპის A ვირუსისათვის დამახასიათებელი ნუკლეოპროტეინის ან მატრიცას ანტიგენების არსებობას. 2. ამ მუხლის პირველი პუნქტით განსაზღვრული ვირუსის გამოვლენის განხორციელება შესაძლებელია გაორმაგებული იმუნოდიფუზური ტესტებით, რომელიც ჩართულია ან კონცენტრირებულია ვირუსულ პრეპარატებში ან ექსტრაქტებში, რომელიც მიღებულია დაინფიცირებული ჩანასახოვანი გარსისგან. 3. ფრინველის გრიპის ვირუსის ანტისხეულების სეროლოგიური გამოკვლევისათვის განკუთვნილ მეთოდებს წარმოადგენენ HA და HI ტესტები. 4. ცხოველთა ჯანმრთელობის დაცვის მსოფლიო ორგანიზაციის (OIE) დიაგნოსტიკური ტესტებისა და ხმელეთის ცხოველების ვაქცინაციის სახელძღვანელოს თავი 2.7.12 მოიცავს დეტალურ ინფორმაციას ლაბორატორიული ტექნიკისა და შედეგების შეფასების შესახებ. თავი IX ვაქცინაციასთან დაკავშირებული მონიტორინგის სისტემა მუხლი 49. წესი და დიაგნოსტიკის სახელმძღვანელო 1. წესის 53-ე-55-ე მუხლების მიხედვით, შესაძლებელია გადაუდებელი და პროფილაქტიკური ვაქცინაციის ჩატარება გარკვეულ პირობებში. ერთ–ერთ პირობას წარმოადგენს DIVA სტრატეგიის გამოყენება. 2. ვაქცინაციის მიზანია ინფექციისა და, შესაბამისად, გუნდებს შორის ვირუსის გავრცელების პრევენცია. არსებობს უდავო მტკიცებულება იმისა, რომ ვაქცინაციის შემდგომ ფრინველის დაინფიცირებისათვის საჭიროა ვირუსის უფრო მეტი რაოდენობა და მცირდება ორგანიზმიდან ვირუსის გამოყოფა. თუმცა, მიუხედავად იმისა, რომ ვაქცინირებულ ფრინველს აღარ უვითარდება კლინიკური ნიშნები, ფრინველის ჯანმრთელობის მდგომარეობის გაუარესების შემთხვევაში, მას კვლავ შეუძლია გარემოში ვირუსის გამოყოფა-გავრცელება. ამრიგად, H5 და H7 ქვეტიპის HPAI-ის გამომწვევი ვირუსი შესაძლოა გარკვეული დროის განმავლობაში ცირკულირებდეს შეუმჩნევლად, გუნდში იმუნიტეტის სუბოპტიმალური დონის არსებობის შემთხვევაში, ისევე, როგორც LPAI-ის გამომწვევი ვირუსი - არავაქცინირებულ გუნდში. აღნიშნულიდან გამომდინარე, არსებობს საველე ვირუსით დაინფიცირებული ვაქცინირებული გუნდების იდენტიფიცირების საჭიროება, რომ შესაძლებელი იქნეს კონტროლის სხვა ზომების (მაგ. სანიტარული დაკვლის) განხორციელება. მუხლი 50. ინდიკატორული ფრინველის გამოყენება ინფექციის მონიტორინგისთვის გუნდის დონეზე, მარტივ მეთოდს წარმოადგენს თითოეულ ვაქცინირებულ გუნდში ვაქცინაციის გარეშე დარჩენილი ინდიკატორული ფრინველის რეგულარული მონიტორინგი, თუმცა, აღნიშნულ მიდგომასთან დაკავშირებით, არსებობს რიგი პრობლემები, რაც უკავშირდება ინდიკატორული ფრინველების იდენტიფიცირებას განსაკუთრებით კი დიდი მოცულობის გუნდში. ვაქცინირებულ და ინდიკატორულ ფრინველებს შორის უზრუნველყოფილი უნდა იქნეს კონტაქტი. მუხლი 51. DIVA ლაბორატორიული გამოკვლევები ინფექციის მონიტორინგისათვის 1. ვაქცინირებულ ფრინველში საველე ვირუსის გამოვლენა ალტერნატივის ან დამატების სახით, შესაძლებელია განხორციელდეს DIVA ლაბორატორიული ტესტებით. ბოლო წლებში შემუშავებული იქნა ტესტირების რამდენიმე სისტემა, რომელთა მეშვეობითაც აგრეთვე შესაძლებელია ვაქცინირებულ ფრინველში საველე ვირუსის ცვლილების გამოვლენა. ერთ–ერთი მეთოდი, რომელიც წარმატებულია აღნიშნულთან დაკავშირებით, მდგომარეობს იმაში, რომ გამოიყენება ისეთი ვაქცინა, რომელიც შეიცავს იმავე H შემცველ ქვეტიპის ვირუსს და დომინირებული საველე ვირუსისგან განსხვავებულ N საველე ვირუსს. N ანტისხეულები მოქმედებენ, როგორც ინფექციის ბუნებრივი მარკერები. 2. 2000 წელს აღნიშნული სისტემა გამოყენებული იქნა იტალიაში LPAI H7N1 ვირუსის განმეორებითი გამოვლენის შემდგომ. იმისათვის, რომ დაემატებინათ პირდაპირი კონტროლის ზომები შემუშავებული იქნა DIVA სტრატეგია, რა დროსაც იყენებდნენ H7N3 შემცველ ვაქცინას H7N1 საველე ინფექციასთან საბრძოლველად. ვაქცინირებული და საველე პირობებში ექსპოზირებული ფრინველის დიფერენცირება განხორციელდა სეროლოგიური გამოკვლევის გამოყენებით, რომლის მიზანსაც წარმოადგენდა ანტი–N1 ანტისხეულების გამოვლენა. 2002-დან 2003 წლამდე ანალოგიური სტრატეგია გამოყენებული იქნა იტალიაში H7N3 გამოწვეული LPAI კონტროლის მიზნით, აღნიშნულ შემთხვევაში H7N1 ვაქცინისა და N3 ანტისხეულების გამომვლენი სეროლოგიური გამოკვლევის გამოყენებით. ორივე შემთხვევაში ვაქცინაციასთან ერთად DIVA სტრატეგიისა და სანიტარული დაკვლის გამოყენებას შედეგად მოჰყვა საველე ვირუსის აღმოფხვრა. 3. აღნიშნულ სისტემასთან დაკავშირებით, პრობლემები წარმოიქმნება არსებული საველე ვირუსის იმავე N ანტიგენის მქონე, თუმცა სხვა H ქვეტიპის, საველე ვირუსის გამოვლენის შემთხვევაში, გარდა H5 ან H7 ქვეტიპისა, ან თუ იმავე N ანტიგენის მქონე ქვეტიპი უკვე გავრცელებულია ველზე. პრქტიკულად მხოლოდ იხვია მატარებელი ერთზე მეტი ქვეტიპისა. აგრეთვე საჭირო იყო შესაბამისი ტესტის შემუშავება, რომელიც მოგვცემდა გუნდში რუტინული მონიტორინგის შესაძლებლობას ანტი–ნეირამინადაზას ანტისხეულებზე. იტალიაში შემუშავებული და გამოყენებული იქნა არაპირდაპირი ფლუორესცენტული ანტისხეულების კვლევაზე დაფუძნებული „სიტუაციური“ სეროლოგიური ტესტირება ბაკულოვირუსის რეკომბინანტით გამოსახული N ანტიგენის პროტეინების გამოყენებით. ELISA ტესტის შემუშავების შემდგომ, აღნიშნული გამოიყენებოდა ფართოდ და შედარებით მარტივად. 4. მხოლოდ HA შემცველი ისეთი ვაქცინების გამოყენება, როგორიცაა რეკომბინანტი ვექტორული ვაქცინა, იძლევა ვაქცინირებულ ფრინველში ინფექციის გამოვლენის მიზნით AGID (gar Gel Immunodiffusion) ტესტების ან ნუკლეოპროტეინებზე, არასტრუქტურულ ცილებზე ან მატრიცის პროტეინებზე დაფუძნებული ELISA ტესტების გამოყენების შესაძლებლობას. 5. ინაქტივირებული ვაქცინებისთვის აღწერილია ტესტი, რომელიც ავლენს მხოლოდ ბუნებრივი დაინფიცირებისას წარმოქმნილი ვირუსის არასტრუქტურული ცილების ანტისხეულებს. აღნიშნული სახის სისტემა ვალიდირებული უნდა იქნეს საველე პირობებში, თუმცა არსებობს შემდეგი შეზღუდვები - ფრინველის გრიპის ნებისმიერი ვირუსის ქვეტიპით გუნდის ბუნებრივ დაინფიცირებას მოჰყვება არასტრუქტურული ცილის საწინააღმდეგო ანტისხეულების წარმოქმნა. 6. ვირუსის გამოვლენის სწრაფი და მგრძნობიარე მეთოდების შემუშავება, განსაკუთრებით კი იმ მეთოდებისა, რომელთა ავტომატიზაციაც შესაძლებელია RT-PCR მსგავსად, ნიშნავს იმას, რომ აღნიშნულის გამოყენება შესაძლებელია ვაქცინირებული ფრინველის რეგულარული გამოკვლევისათვის საველე ვირუსის გამოვლენის მიზნით. თუმცა, აგენტის გამოვლენა შემოიფარგლება ინფექციის მწვავე ფაზით და შეუძლებელია აღნიშნულის გამოყენება წარსულში გუნდის ვირუსით ექსპოზირების დასადგენად. ვაქცინირებული ფრინველის გადაადგილებამდე ტესტირება ხელსაყრელია აქტიური ინფექციისგან თავისუფლების დასადასტურებლად. 7. შესამოწმებელად შერჩეულმა ნიმუშების რაოდენობამ უნდა მოგვცეს გუნდში ფრინველის გრიპის გამომწვევი ვირუსის 15%–ზე მეტი გავრცელების გამორიცხვის შესაძლებლობა, 95%-იანი სანდოობით. თავი X ფრინველის გრიპის დიაგნოსტიკის სტრატეგიები მუხლი 52. დიაგნოსტიკის სტრატეგიის განმსაზღვრელი ფაქტორები 1. წესის პირველი დანართის შესაბამისად, ზონებში და კონტაქტურ საფრინველეში გამოსაყენებელი ზომების შესახებ გადაწყვეტილება და აღნიშნული ზომების სიმკაცრე შესაძლოა მერყეობდეს რისკის შესაბამისად. ანალოგიურად, დაავადების დადასტურებისათვის საჭირო დიაგნოსტიკა დაბალანსებული უნდა იქნეს არსებულ სიტუაციასთან, საფრთხის მასშტაბთან და რისკის ხარისხთან. სააგენტოს მიერ მიღებული უნდა იქნეს გადაწყვეტილება იმ დიაგნოსტიკური გამოკვლევების გამოყენებაზე, რომელიც დააბალანსებს დაავადების სწრაფ კონტროლსა და აღმოფხვრას შეცდომითი დიაგნოზის პოტენციურ ზემოქმედებასთან დაკავშირებით. ასეთი გადაწყვეტილება უნდა განხორციელდეს მრავალი ფაქტორის ფონზე, თუმცა წინაწარ უნდა იქნეს განსაზღვრული რიგი ვითარება. 2. ამ მუხლის პირველ პუნქტში მითითებული ფაქტორები მოცემულია დანართში №3 „დიაგნოსტიკის სტრატეგიის განმსაზღვრელი ფაქტორები“.
თავი XI ფრინველის გრიპის დიაგნოსტიკა ღორებში და სხვა ძუძუმწოვრებში მუხლი 53. ფრინველის გრიპი ღორებში 1. ღორების დაინფიცირება ფრინველის გრიპის გამომწვევი ვირუსით სწრაფად ხდება და მიუხედავად იმისა, რომ განმეორებითი შემთხვევები შედარებით იშვიათია, არსებობს პოტენციალი იმისა, რომ დაინფიცირებულმა ღორმა დაავადება გადასდოს ფრინველებსა და სხვა ცხოველებს. დღეისათვის, არ არსებობს მტკიცებულება დაინფიცირებული ღორების მიერ H5 და H7 ქვეტიპის ფრინველის გრიპის გამომწვევი ვირუსის გადადების შესახებ. 2. 2003 წელს ნიდერლანდებში მომხდარი ვირუსის აფეთქების შედეგად მიღებული გამოცდილება მიუთითებს იმაზე, რომ H7N7 დაინფიცირებულ ღორებს არ აღენიშნებოდათ ამ ინფექციისათვის დამახასიათებელი კლინიკური ნიშნები. უფრო მეტიც, აზიაში და სხვა ქვეყნებში H5N1 ვირუსის აფეთქებისას დღემდე არ გამოვლენილა ღორების დაინფიცირების ფაქტები. 3. კლინიკური ნიშნებით არ განისაზღვრება ღორების დაინფიცირება, თუმცა ფრინველის გრიპის გამომწვევი სხვა ვირუსით ღორების დაინფიცირების კლინიკური გამოვლენა შესაძლოა განხორციელდეს ვირუსის და მისი მასპინძლის ადაპტირებისთანავე. ფრინველის გრიპის ვირუსის დიაგნოსტიკა ღორებში თითქმის მსგავსია ფრინველის სახეობებში დიაგნოსტიკისა, და იგი ეფუძნება ვირუსის გამოყოფას, მოლეკულური გამოკვლევის ტექნიკასა და HI ტესტირების გზით სპეციფიკური ანტისხეულების გამოვლენას. თუმცა, განსხვავება იმაშია, რომ არც ერთი ტესტი არ არის სრულად ვალიდირებული ღორებში ფრინველის გრიპის გამომწვევი ვირუსის დასადასტურებლად. მუხლი 54. ნიმუშები ვირუსის გამოსაყოფად ფრინველის გრიპის გამომწვევი ვირუსი ღორში, როგორც წესი, ვითარდება რესპირატორულ ტრაქტში, შესაბამისად, ნიმუშები აღებულ უნდა იქნეს რესპირატორული ტრაქტის ქსოვილიდან, ხოლო საჭიროების შემთხვევაში, დაავადების ნიშნების მქონე ღორიდან აიღება ოროფარინგეალური ან ნაზალური ნაცხები. ნიმუშები და ნაცხები შესაძლოა დამუშავდეს ვირუსის გამოსაყოფად ან ვირუსის მოლეკულულ დონეზე დიაგნოსტიკისათვის, რა დროსაც გამოიყენება ფრინველიდან აღებული ნიმუშების გამოსაკვლევად ზემოთ აღწერილი ტექნიკა. თუმცა, PCR -ით დიაგნოსტიკის დროს, გამოყენებულ უნდა იქნეს შესაბამისი კონტროლი რათა დავრწმუნდეთ, რომ ამპლიფიკაცია არ ფერხდება ღორიდან აღებულ ნიმუშში არსებული ნივთიერებებით. მუხლი 55. კვერცხის ინოკულაცია და ინკუბაცია 1. ძუძუმწოვრების გრიპის ვირუსის გამოყოფისათვის გამოიყენება 9-დან 11 დღიანი ემბრიონირებული კვერცხი. თითოეული კვერცხის ინოკულაცია ხდება ალანტოისურ და ამნიოტურ ღრუში. თუმცა, როდესაც ფრინველის გრიპის გამომწვევ ვირუსს აქვს მცირე შესაძლებლობა ღორში შეგუებისა, შემოწმებისთვის სავარაუდოდ ხელსაყრელია ინოკულაცია ალანტოისურ ღრუში. 2. ანალოგიურად, ძუძუმწოვრების A ტიპის გრიპის ვირუსის გამოყოფისათვის, რეკომენდებულია ინკუბაცია 35oC-ზე, თუმცა 37oC არ იქნება საზიანო იმ ვირუსის გამოსაყოფად, რომელიც ცუდადაა ადაპტირებული ღორში. მუხლი 56. HI ტესტით სპეციფიკური ანტისხეულების გამოვლენა 1. ღორში ფრინველის გრიპის გამომწვევი ვირუსის ინფექციის განსასაზღვრად, მეტად მგრძნობიარე მეთოდს წარმოადგენს ვირუსის გამოყოფა ან მოლეკულური დიაგნოსტიკა. თუმცა, ღორში სეროლოგიური რეაქციებით გამოვლენილი იქნა ვირუსი მისი გამოყოფის ან გამოვლენის არარსებობის შემთხვევაშიც. ღორის შრატის გამოკვლევის HI ტესტები, რომელიც გამოყენებულია ამ დიაგნოსტიკური სახელმძღვანელოს მე-8 თავში მითითებული ფრინველის შრატის გამოკვლევისათვის, საჭიროებს რიგ შესწორებებსა და მოდიფიკაციებს. 2. ღორის შრატი ზოგადად ცნობილია HI ტესტებში არასპეციფიური ინჰიბირების მახასიათებლებით და მისგან დასაცავად შრატის თითოეული ნიმუში დამუშავებული უნდა იქნეს RDE-ით. გამოყენებული უნდა იქნეს შემდეგი მეთოდი: ა) ღორის 100 µl იმუნურ შრატს ემატება 400 µl RDE (წინასწარ განსაზღვრული სამუშაო გაზავება) და შეერიოს კარგად; ბ) ხორციელდება ინკუბაცია 37oC-ზე ერთი საათი; გ) აღნიშნულის შემდგომ ინკუბაცია უნდა განხორციელდეს არანაკლებ 56oC-ზე 30 წუთი; დ) ნიმუშები ცივდება 4oC-ზე არანაკლებ 15 წუთი; ე) ემატება 10 µl 30 % (v/v ერითროციტების მასა) ქათმის სისხლის წითელი უჯრედები და უნდა შეერიოს კარგად; ვ) განხორციელდეს ინკუბაცია 4oC-ზე მთელი ღამის განმავლობაში. ალტერნატივის სახით, თუ ნიმუშის იმავე დღეს გამოყენება მნიშვნელოვანია, ინკუბაცია უნდა განხორციელდეს 37oC-ზე ერთი საათის განმავლობაში და ცენტრიფუგირება კი 300 x g–ზე ხუთი წუთის განმავლობაში. 3. შემდგომ დამუშავებული შრატი გამოიყენება ფრინველის შრატთან დაკავშირებით აღწერილი HI ტესტირებისას, პირველადი განზავება - 1:10. ღორების შრატის ნაკრები, რომელიც ფრინველის გრიპთან მიმართებაში ცნობილია სერო–ნეგატიური სტატუსით, გამოყენებული უნდა იქნეს ვირუსის შტამის HI ტესტების სპეციფიკის შეფასებისას (ამ დიაგნოსტიკური სახელმძღვანელოს მე-8 თავი). 2003 წელს ნიდერლანდებში მომხდარი აფეთქებისას, აფეთქებისგან დამოუკიდებლად შეგროვებული ღორის შრატის გამოყენებით ჩატარებულ HI ტესტირებისას გამოვლენილი იქნა 2,6%–მდე არასპეციფიკური რეაქტორები.
მუხლი 57. ნიმუშების აღება ღორში 1. იმ ფერმებში, სადაც ღორი და ფრინველი მოთავსებულია ერთად შერეულ ან ცალკეულ სადგომში, ფრინველთან ან ფრინველის პროდუქციასთან შეხების გამო, ღორი იმყოფება ფრინველის გრიპის გამომწვევი ვირუსით პირდაპირი ან არაპირდაპირი დაინფიცირების რისკის ქვეშ. აღნიშნული სახის დაინფიცირების გამორიცხვისათვის ,ოროფარინგეალური ან ნაზალური ნაცხი და სისხლის ანალიზი აღებული უნდ იქნეს ამ დიაგნოსტიკური სახელმძღვანელოს 38-ე მუხლში აღწერილი პროცედურების შესაბამისად. ნიმუშები აღებული უნდა იქნეს იმ ღორიდან, რომლებსაც აღენიშნებათ დაავადების კლინიკური ნიშნები. თუმცა, კლინიკური ნიშნების არარსებობის შემთხვევაში, ნიმუშების აღება შესაძლებელია განხორციელდეს შემთხვევითი შერჩევის მეთოდით, სადგომის ყოველ ნაწილში. ლაბორატორიაში, შესაძლებლობის ფარგლებში, ნაცხის ნიმუშები შემოწმებული უნდა იქნეს სწრაფი მოლეკულური ტესტით და/ან ვირუსის გამოყოფით. RT-PCR უნდა იქნეს შესაბამისად ვალიდირებული და გააჩნდეს სულ მცირე ეკვივალენტური მგრძნობელობა კვერცხში ფრინველის გრიპის A ტიპის ვირუსის გამოყოფასთან დაკავშირებით. 2. ფრინველის გრიპის გამომწვევი ვირუსით დაინფიცირებული ფრინველის გამოწუნების შემდგომ, ორიდან ოთხ კვირამდე პერიოდის განმავლობაში, არანაკლებ სისხლის 60 ნიმუში აღებული უნდა იქნეს ღორისგან ისე, რომ სულ მცირე რამდენიმე ნიმუში მაინც იქნეს აღებული ღორების იმ ჯგუფიდან, რომლებსაც უშუალო კონტაქტი აქვთ ერთმანეთთან. ნიმუშების ტესტირება უნდა განხორციელდეს HI ტესტით და გამოყენებული იქნეს ფრინველის გრიპის აფეთქებისას ფრინველიდან მოპოვებული ვირუსი. როგორც მწვავე, ასევე გამოჯანმრთელების ფაზაში, აღებული ნიმუშების გამოკვლევა უნდა მოხდეს ერთი და იგივე ტესტით. დადებითი ნიმუშების დადასტურება შესაძლებელია ვირუსის ნეიტრალიზაციის და/ან Western blot-ის ანალიზით. 3. ნებისმიერ ნიმუშზე დადებითი პასუხის შემთხვევაში ეპიდემიოლოგიური მოკვლევა უნდა განხორციელდეს დამცავ ზონაში მდებარე ღორის ყველა ფერმაში მიუხედავად იმისა შერეული ტიპისაა თუ არა.
მუხლი 58. ფრინველის გრიპის გამომწვევი ვირუსი სხვა ძუძუმწოვრებში (გარდა ღორებისა) 1. ფრინველის გრიპის გამომწვევი ვირუსის მიმართ მგრძნობიარე ძუძუმწოვრებში, მათ შორის კატებშიც, უნდა განხორციელდეს გამოკვლევა. HPAI-ის H5N1 შემთხვევაში კატების გამოკვლევასთან დაკავშირებით უნდა განხორციელდეს შემდეგი: ვირუსის რეპლიკაციასთან დაკავშირებული პათოლოგიური დარღვევები კონცენტრირებულია ფილტვებსა და ღვიძლზე, ამიტომ ვირუსოლოგიური გამოკვლევისათვის საჭირო ნიმუშები აღებული უნდა იქნეს მკვდარი ცხოველების აღნიშნული ორგანოებიდან. ცოცხალ ცხოველებში ვირუსის გამოვლენის მიზნით უმჯობესია ტრაქეალურ/ოროფარინგეალური ნაცხის აღება. გარდა ამისა, შესაძლებელია აღებული იქნეს ცალკე ფეკალიის ნაცხიც. 2. HI კვლევისათვის შესასწავლი სისხლის ანალიზი საჭიროებს თერმულ დამუშავებას 56oC-ზე 30 წუთის განმავლობაში და შესაძლებელია RDE -ით დამუშავების გამოტოვება. თავი XII ნიმუშების გადატანასთან დაკავშირებული უსაფრთხოების მინიმალური მოთხოვნები მუხლი 59. ზოგადი დებულება 1. იმ ნიმუშების ტრანსპორტირება, რომლებშიც არსებობენ პათოგენები, ან არსებობს ვარაუდი მათში ამგვარი პათოგენების არსებობაზე, ექვემდებარება ამ დიაგნოსტიკური სახელმძღვანელოთი დადგენილ და საერთაშორისო მოთხოვნებს. ვირუსის შტამი არ კლასიფიცირდება სადიაგნოსტიკო ნიმუშად, თუმცა აღნიშნული შეფუთული უნდა იქნეს საერთაშორისო სტანდარტების შესაბამისად. 2. ამ თავში წარმოდგენილი ინსტრუქციები განკუთვნილია საჰაერო ტრანსპორტირებისათვის, თუმცა სახმელეთო ან საზღვაო გადაზიდვების შემთხვევაში გამოყენებული უნდა იქნეს შეფუთვის ანალოგიური წესები. მუხლი 60. დიაგნოსტიკისათვის განკუთვნილი ნიმუშების შეფუთვა შემდგომი ტრანსპორტირებისათვის 1. IATA (საერთაშორისო საჰაერო ტრანსპორტის ასოციაცია) რეგულაციების თანახმად დიაგნოსტიკისათვის განკუთვნილი ნიმუშების ტრანსპორტირებისას, საჭიროების შემთხვევაში, ენიჭება UN საიდენტიფიკაციო ნომერი 2814, 2900 ან 3373. 2. ტვირთის გამგზავნს და არა სატრანსპორტო კომპანიას, ეკისრება პასუხისმგებლობა გადაზიდვაზე მანამ, სანამ შეფუთვა არ მიაღწევს ტვირთის მიმღებთან. 3. პირველადი შეფუთვისას: ა) პირველადი ტარა უნდა იყოს წყალგაუმტარი (მაგალითად, ხრახნის თავი დალუქული უნდა იქნეს პარაფინით ან საიზოლაციო ლენტით) ან განხორციელებული უნდა იქნეს სხვა მსგავსი დამცავი ღონისძიებები; ბ) რამდენიმე პირველადი ტარის არსებობის შემთხვევაში უნდა მოხდეს მათი ინდივიდუალური შეფუთვა დაზიანების თავიდან აცილების მიზნით; გ) დიაგნოსტიკისათვის განკუთვნილი გადასაზიდი ნიმუშების რაოდენობა უნდა განისაზღვროს ვირუსის სატრანსპორტო გარემოს გათვალისწინებით; დ) პირველად ტარაში მოთავსებული ნიმუშის წონა არ უნდა აღემატებოდეს 500 გრამს ან 500 მილიგრამს; ე) პირველად ტარაში მოთავსებული უნდა იქნეს მხოლოდ დიაგნოსტიკისათვის განკუთვნილი ნიმუშები. 4. მეორადი შეფუთვისას: ა) მეორად კონტეინერში უნდა იქნეს საკმარისი რაოდენობის შემწოვი მასალა, რომელიც პირველადი ტარის დაზიანების ან გაჟონვის შემთხვევაში შეიწოვს ტარის შიგთავსს; ბ) მეორადი შეფუთვა უნდა აკმაყოფილებდეს დიაგნოსტიკისათვის განკუთვნილ ნიმუშებთან დაკავშირებულ IATA შეფუთვის მოთხოვნებს, რაც აგრეთვე მოიცავს 1,2 მეტრიდან (3,9 ფუტი) დავარდნის ტესტირების პროცედურებს. თუ დაინფიცირებული ნივთიერებების შეფუთვა აღემატება დიაგნოსტიკისათვის განკუთვნილი ნიმუშების IATA შეფუთვის N602 ინსტრუქციის მოთხოვნებს, დასაშვებია აღნიშნულის გამოყენება; გ) დაინფიცირებული ნივთიერების შეფუთვაზე გაკეთებული უნდა იქნეს შესაბამისი მარკირება (UN უნდა იყოს შემოხაზული); დ) მეორადი შეფუთვა უნდა იყოს წყალგაუმტარი. დაცული უნდა იქნეს შეფუთვის მწარმოებლის ან სხვა უფლებამოსილი მხარის შეფუთვასთან დაკავშირებით დაწესებული ინსტრუქციები; ე) მეორადი შეფუთვა უნდა იყოს სულ მცირე 100 მმ უმცირესი საერთო გარეთა გაბარიტით; ვ) მეორადი შეფუთვა უნდა იყოს შესაბამისი ზომის სატრანსპორტო დოკუმენტაციისათვის, როგორიცაა საჰაერო ზედნადები. 5. გარეთა შეფუთვისას: ა) გარეთა შეფუთვის წონა არ უნდა აღემატებოდეს 4 ლ ან 4 კგ–ს; ბ) საჭიროების შემთხვევაში მეორადი შეფუთვის გარეთა მხარეს შესაძლებელია მშრალი ან სველი ყინულის მოთავსება. მშრალი ყინულის გამოყენების შემთხვევაში შეფუთვით დაშვებულია ნახშიროჟანგის გაშვება წნევის წარმოქმნის გარეშე, რათა თავის მხრივ არ გამოიწვიოს შეფუთვის დაზიანება. სველი ყინულის გამოყენების შემთხვევაში შეფუთვა უნდა იყოს ჰერმეტული; გ) მეორად შეფუთვასა და გარეთა შეფუთვას შორის მოთავსებული უნდა იქნეს შემადგენლობის დეტალურად აღწერილი ჩამონათვალი; დ) გარეთა შეფუთვა სინესტისგან დაცვის მიზნით მოთავსებული უნდა იქნეს დალუქულ პლასტიკურ ჩანთაში; ე) ტვირთის გამგზავნის დეკლარაცია საფრთხის შემცველ საქონელთან დაკავშირებით არ მოითხოვება. 6. თითოეული შეფუთვა და საჰაერო ზედნადები მარკირებული უნდა იქნეს შემდეგი სიტყვებით: „UN 3373 დიაგნოსტიკისათვის განკუთვნილი ნიმუში შეფუთულია IATA შეფუთვის N650 ინსტრუქციის შესაბამისად“. თავი XIII ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიის უსაფრთხოების მინიმალური მოთხოვნები მუხლი 61. ზოგადი დებულება 1. ფრინველის გრიპის გამომწვევ ვირუსზე მომუშავე დიაგნოსტიკური ლაბორატორიების უსაფრთხოების მოთხოვნები უნდა მოიცავდეს, როგორც ვირუსის შეკავებას, რომელიც ქმნის ცხოველის სიცოცხლის საფრთხეს, ასევე ლაბორატორიაში მომუშავეთა (აგრეთვე ლაბორატორიის გარეთ მყოფთა) დაცვას ზოონოზური რისკისგან. 2. ფრინველის გრიპის გამომწვევ ვირუსზე მომუშავე დიაგნოსტიკური ლაბორატორია უნდა აკმაყოფილებდეს და ზედმიწევნით ასრულებდეს მსოფლიო ჯანდაცვის ორგანიზაციის (WHO) მიერ ბიოუსაფრთხოების სახელმძღვანელოთი დადგენილ მოთხოვნებს. 3. ლაბორატორიისათვის უსაფრთხოებასთან დაკავშირებული მოთხოვნები მოცემულია დანართში №4 „ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიასთან დაკავშირებული უსაფრთხოების მოთხოვნები“. დანართი №1 დიაგნოსტიკის ეტაპების სქემატური მიმოხილვა ფრინველის გრიპის დადასტურებისათვის
დანართი №2 შედეგების ჩაწერისა და ინდექსების გამოთვლის მარტივი მეთოდი
დანართი №2-ის დაანგარიშების განმარტება: 10 დღის განმავლობაში დაკვირვება განხორციელდა 10 ფრინველზე = 100 დაკვირვება ინდექსი = თითოეული ფრინველის მაჩვენებელი თითოეულ დაკვირვებაზე = 246/100 = 2,46 მიუხედავად ქვეტიპისა ნებისმიერი გრიპის A ვირუსი, რომელიც IVPI ტესტირებისას გვაძლევს 1,2 -ზე მაღალ მაჩვენებელს, განიხილება HPAI ვირუსად. დანართი №3 დიაგნოსტიკის სტრატეგიის განმსაზღვრელი ფაქტორები
(1) სრული დიაგნოსტიკური გამოკვლევისათის აღებული უნდა იქნეს ნიმუშები სრულად და შენახული შემდგომი შეფასებისათვის. დანართი №4 ფრინველის გრიპის დიაგნოსტიკაზე მომუშავე ლაბორატორიასთან დაკავშირებული უსაფრთხოების მოთხოვნები
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 უკან დაბრუნება
უკან დაბრუნება 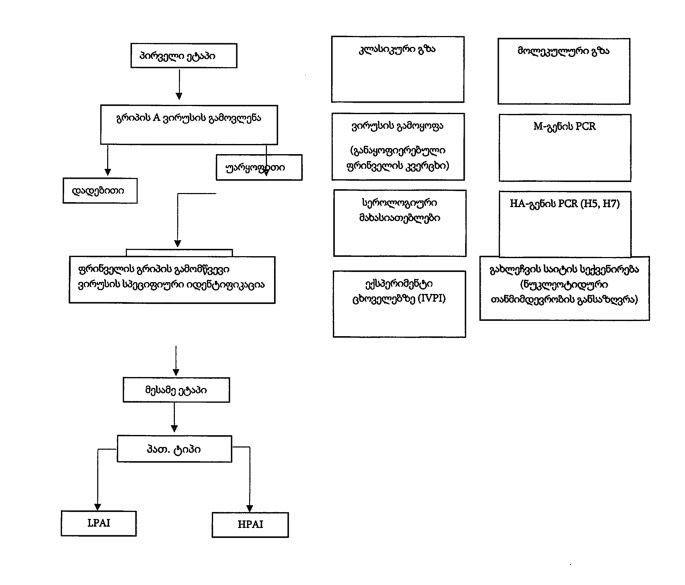
დოკუმენტის კომენტარები